Cella a combustibile fai da te a casa. La tecnologia delle celle a combustibile e il suo utilizzo nelle automobili
Alla luce dei recenti avvenimenti legati a surriscaldamenti, incendi e perfino esplosioni di computer portatili dovuti a guasti delle batterie agli ioni di litio, non si può fare a meno di ricordare nuove tecnologie alternative, che, secondo la maggior parte degli esperti, in futuro potranno integrare o sostituire le tradizionali batterie ricaricabili di oggi. Stiamo parlando di nuove fonti di energia: le celle a combustibile.
Secondo una legge empirica formulata 40 anni fa da uno dei fondatori di Intel, Gordon Moore, le prestazioni dei processori raddoppiano ogni 18 mesi. Le batterie non riescono a tenere il passo con i chip. La loro capacità, secondo gli esperti, aumenta solo del 10% all'anno.
La cella a combustibile funziona sulla base di una membrana cellulare (porosa) che separa gli spazi anodico e catodico della cella a combustibile. Questa membrana è rivestita su entrambi i lati con opportuni catalizzatori. All'anodo viene fornito carburante; in questo caso viene utilizzata una soluzione di metanolo (alcol metilico). Come risultato della reazione chimica di decomposizione del carburante, si formano cariche libere che penetrano attraverso la membrana fino al catodo. Il circuito elettrico viene così chiuso e al suo interno viene creata una corrente elettrica per alimentare il dispositivo. Questo tipo di cella a combustibile è chiamata cella a combustibile diretta al metanolo (DMFC). Lo sviluppo delle celle a combustibile è iniziato molto tempo fa, ma i primi risultati, che hanno fatto parlare di vera concorrenza con le batterie agli ioni di litio, sono stati ottenuti solo negli ultimi due anni.
Nel 2004 c'erano circa 35 produttori sul mercato di tali dispositivi, ma solo poche aziende hanno potuto dichiarare un successo significativo in questo settore. A gennaio Fujitsu ha presentato il suo sviluppo: la batteria aveva uno spessore di 15 mm e conteneva 300 mg di una soluzione di metanolo al 30%. Una potenza di 15 W ha permesso di alimentare il portatile per 8 ore. Un mese dopo, una piccola azienda, PolyFuel, fu la prima ad annunciare il lancio della produzione commerciale delle stesse membrane che avrebbero dovuto essere dotate di alimentatori a combustibile. E già a marzo, Toshiba ha presentato un prototipo di PC mobile alimentato a carburante. Il produttore ha dichiarato che un laptop di questo tipo può durare cinque volte di più di un laptop che utilizza una batteria tradizionale.
Nel 2005, LG Chem ha annunciato la creazione della propria cella a combustibile. Per il suo sviluppo sono stati spesi circa 5 anni e 5 miliardi di dollari. Di conseguenza, è stato possibile creare un dispositivo con una potenza di 25 W e un peso di 1 kg, collegato a un laptop tramite un'interfaccia USB e garantendone il funzionamento per 10 ore. Anche quest'anno, il 2006, è stato caratterizzato da una serie di sviluppi interessanti. In particolare, gli sviluppatori americani della ditta Ultracell hanno presentato una cella a combustibile che fornisce una potenza di 25 W ed è dotata di tre cartucce sostituibili con il 67% di metanolo. È in grado di alimentare un laptop per 24 ore. Il peso della batteria era di circa un chilogrammo, ogni cartuccia pesava circa 260 grammi.
Oltre ad essere in grado di fornire una capacità maggiore rispetto alle batterie agli ioni di litio, le batterie al metanolo sono non esplosive. Gli svantaggi includono il costo piuttosto elevato e la necessità di sostituire periodicamente le cartucce di metanolo.
Anche se le batterie a combustibile non sostituiscono quelle tradizionali, molto probabilmente verranno utilizzate insieme ad esse. Secondo gli esperti, nel 2006 il mercato delle celle a combustibile ammonterà a circa 600 milioni di dollari, una cifra piuttosto modesta. Tuttavia, entro il 2010, gli esperti prevedono che triplicherà, fino a 1,9 miliardi di dollari.
Discussione dell’articolo “Le batterie all’alcool stanno sostituendo quelle al litio”
zemoneng
Santo cielo, ho trovato informazioni su questo dispositivo in una rivista femminile.
Bene, dirò alcune parole a riguardo:
1: l'inconveniente è che dopo 6-10 ore di funzionamento bisognerà cercare una nuova cartuccia, che è costosa. Perché dovrei spendere soldi per queste sciocchezze?
2: a quanto ho capito, dopo aver ricevuto energia dall'alcol metilico, dovrebbe essere rilasciata acqua. Un laptop e l'acqua sono cose incompatibili.
3: perché scrivi su riviste femminili? A giudicare dai commenti “Non so niente” e “Che cos’è?”, questo articolo non è al livello di un sito dedicato alle BELLEzze.
Inserisco il raccordo del tubo di rifornimento nel bocchettone di rifornimento del carburante e lo giro di mezzo giro per sigillare il collegamento. Un clic sull'interruttore a levetta e il LED lampeggiante sulla pompa di benzina con un'enorme scritta h3 indicano che il rifornimento è iniziato. Un minuto e il serbatoio è pieno, puoi andare!
I contorni eleganti della carrozzeria, le sospensioni ultra-ribassate e gli slick a basso profilo emanano una vera razza da corsa. Attraverso la copertura trasparente è visibile un'intricata rete di condutture e cavi. Ho già visto una soluzione simile da qualche parte... Eh sì, sull'Audi R8 il motore è visibile anche attraverso il lunotto. Ma su Audi è la benzina tradizionale e questa macchina funziona a idrogeno. Come la BMW Hydrogen 7, ma a differenza di quest'ultima non è presente il motore a combustione interna. Le uniche parti mobili sono la scatola dello sterzo e il rotore del motore elettrico. E l'energia è fornita da una cella a combustibile. Questa vettura è stata prodotta dalla società singaporiana Horizon Fuel Cell Technologies, specializzata nello sviluppo e nella produzione di celle a combustibile. Nel 2009, la società britannica Riversimple aveva già introdotto un’auto urbana a idrogeno alimentata dalle celle a combustibile Horizon Fuel Cell Technologies. È stato sviluppato in collaborazione con le università di Oxford e Cranfield. Ma Horizon H-racer 2.0 è uno sviluppo solista.
La cella a combustibile è costituita da due elettrodi porosi rivestiti con uno strato di catalizzatore e separati da una membrana a scambio protonico. L'idrogeno nel catalizzatore dell'anodo viene convertito in protoni ed elettroni, che viaggiano attraverso l'anodo e un circuito elettrico esterno fino al catodo, dove idrogeno e ossigeno si ricombinano per formare acqua.
"Andare!" - il caporedattore mi dà una gomitata alla Gagarin. Ma non così in fretta: prima bisogna “riscaldare” la cella a combustibile a carico parziale. Metto l'interruttore a levetta sulla modalità "riscaldamento" e aspetto il tempo assegnato. Poi, per ogni evenienza, rabbocco il serbatoio finché non è pieno. Ora andiamo: l'auto, con il motore che ronza dolcemente, avanza. La dinamica è impressionante, anche se, a proposito, cos'altro puoi aspettarti da un'auto elettrica: la coppia è costante a qualsiasi velocità. Anche se non per molto: un serbatoio pieno di idrogeno dura solo pochi minuti (Horizon promette di rilasciare una nuova versione nel prossimo futuro, in cui l'idrogeno non viene immagazzinato come gas sotto pressione, ma viene trattenuto da un materiale poroso nell'adsorbitore ). E, francamente, non è molto controllabile: ci sono solo due pulsanti sul telecomando. Ma in ogni caso è un peccato che si tratti solo di un giocattolo radiocomandato, che ci è costato 150 dollari. Non ci dispiacerebbe guidare una vera macchina con celle a combustibile per produrre energia.
Il serbatoio, un contenitore di gomma elastica all'interno di un involucro rigido, si allunga durante il rifornimento e funziona come una pompa del carburante, “spremendo” l'idrogeno nella cella a combustibile. Per non “riempire troppo” il serbatoio, uno dei raccordi è collegato con un tubo di plastica alla valvola limitatrice di pressione di emergenza.

Stazione di servizio
Fallo da solo
La macchina Horizon H-racer 2.0 viene fornita in kit per il grande assemblaggio (tipo fai da te), potete acquistarlo, ad esempio, su Amazon. Tuttavia, assemblarlo non è difficile: basta posizionare la cella a combustibile e fissarla con le viti, collegare i tubi al serbatoio dell'idrogeno, alla cella a combustibile, al bocchettone di riempimento e alla valvola di emergenza, e tutto ciò che resta da fare è posizionare la parte superiore della carrozzeria a posto, senza dimenticare i paraurti anteriore e posteriore. Il kit comprende una stazione di rifornimento che produce idrogeno mediante elettrolisi dell'acqua. Si alimenta con due batterie stilo AA e, se si vuole che l'energia sia completamente “pulita”, con i pannelli solari (anch'essi compresi nel kit).
www.popmech.ru
Come realizzare una cella a combustibile con le tue mani?
Naturalmente, la soluzione più semplice al problema di garantire il funzionamento costante dei sistemi senza carburante è acquistare una fonte di energia secondaria già pronta su base idraulica o di altro tipo, ma in questo caso non sarà certamente possibile evitare ulteriori costi, e in questo processo è abbastanza difficile prendere in considerazione qualsiasi idea per la fuga del pensiero creativo. Inoltre, realizzare una cella a combustibile con le proprie mani non è così difficile come si potrebbe pensare a prima vista, e se lo si desidera, anche l'artigiano più inesperto può far fronte al compito. Inoltre, un bonus più che piacevole sarà il basso costo di creazione di questo elemento, perché nonostante tutti i suoi vantaggi e il suo significato, puoi assolutamente accontentarti dei mezzi che hai già a portata di mano.
In questo caso, l'unica sfumatura che deve essere presa in considerazione prima di completare l'attività è che è possibile realizzare un dispositivo a bassissimo consumo con le proprie mani e l'implementazione di installazioni più avanzate e complesse dovrebbe comunque essere lasciata a specialisti qualificati. Per quanto riguarda l'ordine di lavoro e la sequenza delle azioni, il primo passo è completare la carrozzeria, per la quale è meglio utilizzare plexiglass a pareti spesse (almeno 5 centimetri). Per incollare le pareti del case e installare le partizioni interne, per le quali è meglio usare il plexiglass più sottile (3 millimetri sono sufficienti), idealmente usa la colla bicomposita, anche se se lo desideri davvero, puoi eseguire tu stesso una saldatura di alta qualità, utilizzando le seguenti proporzioni: per 100 grammi di cloroformio - 6 grammi di trucioli dello stesso plexiglass.
In questo caso, il processo deve essere eseguito esclusivamente sotto cappa. Per dotare la custodia del cosiddetto sistema di scarico, è necessario praticare con attenzione un foro passante nella parete anteriore, il cui diametro corrisponderà esattamente alle dimensioni del tappo di gomma, che funge da sorta di guarnizione tra la custodia e il tubo di scarico in vetro. Per quanto riguarda le dimensioni del tubo stesso, idealmente la sua larghezza dovrebbe essere compresa tra cinque e sei millimetri, anche se tutto dipende dal tipo di struttura da progettare. È più probabile affermare che la vecchia maschera antigas elencata nell'elenco degli elementi necessari per realizzare una cella a combustibile susciterà qualche sorpresa tra i potenziali lettori di questo articolo. Nel frattempo, l'intero vantaggio di questo dispositivo risiede nel carbone attivo situato nei compartimenti del suo respiratore, che può successivamente essere utilizzato come elettrodi.
Dato che stiamo parlando di una consistenza polverosa, per migliorare il design avrete bisogno di calze di nylon, dalle quali potrete facilmente realizzare un sacchetto e metterci dentro il carbone, altrimenti semplicemente fuoriuscirà dal buco. Per quanto riguarda la funzione di distribuzione, la concentrazione del combustibile avviene nella prima camera, mentre l'ossigeno necessario al normale funzionamento della cella a combustibile, al contrario, circolerà nell'ultimo, quinto compartimento. L'elettrolita stesso, situato tra gli elettrodi, deve essere immerso in una soluzione speciale (benzina con paraffina in un rapporto da 125 a 2 millilitri), e questo deve essere fatto prima di posizionare l'elettrolita dell'aria nel quarto compartimento. Per garantire una corretta conduttività, sopra il carbone vengono posate piastre di rame con fili pre-saldati, attraverso i quali l'elettricità verrà trasmessa dagli elettrodi.
Questa fase di progettazione può essere tranquillamente considerata la fase finale, dopo la quale viene caricato il dispositivo finito, per il quale sarà necessario un elettrolita. Per prepararlo è necessario mescolare l'alcol etilico con acqua distillata in parti uguali e iniziare ad introdurre gradualmente potassio caustico in ragione di 70 grammi per bicchiere di liquido. Il primo test del dispositivo prodotto prevede il riempimento simultaneo del primo (liquido combustibile) e del terzo (elettrolita costituito da alcol etilico e potassio caustico) del contenitore in plexiglass.
uznay-kak.ru
Celle a combustibile a idrogeno | LAVENTO
Da tempo desideravo parlarvi di un'altra direzione dell'azienda Alfaintek. Questo è lo sviluppo, la vendita e l'assistenza di celle a combustibile a idrogeno. Vorrei spiegare subito la situazione di queste celle a combustibile in Russia.
A causa del costo piuttosto elevato e della totale mancanza di stazioni di idrogeno per la ricarica di queste celle a combustibile, non è prevista la loro vendita in Russia. Tuttavia, in Europa, soprattutto in Finlandia, queste celle a combustibile stanno guadagnando popolarità ogni anno. Qual è il segreto? Diamo un'occhiata.  Questo dispositivo è ecologico, facile da usare ed efficace. Viene in aiuto di una persona dove ha bisogno di energia elettrica. Puoi portarlo con te in viaggio, durante un'escursione o utilizzarlo nella tua casa di campagna o appartamento come fonte autonoma di elettricità.
Questo dispositivo è ecologico, facile da usare ed efficace. Viene in aiuto di una persona dove ha bisogno di energia elettrica. Puoi portarlo con te in viaggio, durante un'escursione o utilizzarlo nella tua casa di campagna o appartamento come fonte autonoma di elettricità.
L'elettricità in una cella a combustibile è generata da una reazione chimica dell'idrogeno contenuto nel serbatoio con l'idruro metallico e l'ossigeno dell'aria. La bombola non è esplosiva e può essere conservata nel tuo armadio per anni, in attesa dietro le quinte. Questo è forse uno dei principali vantaggi di questa tecnologia di stoccaggio dell’idrogeno. È lo stoccaggio dell'idrogeno uno dei principali problemi nello sviluppo del combustibile a idrogeno. Nuove ed esclusive celle a combustibile leggere che convertono l'idrogeno in elettricità convenzionale in modo sicuro, silenzioso e senza emissioni.
Questo tipo di elettricità può essere utilizzata in luoghi in cui non è presente l'elettricità centrale o come fonte di energia di emergenza.
A differenza delle batterie convenzionali, che durante il processo di ricarica devono essere caricate e scollegate dall’utenza elettrica, una cella a combustibile funziona come un dispositivo “intelligente”. Questa tecnologia fornisce energia ininterrotta durante l'intero periodo di utilizzo grazie all'esclusiva funzione di risparmio energetico quando si cambia il contenitore del carburante, che consente all'utente di non spegnere mai il consumatore. In un involucro chiuso, le celle a combustibile possono essere conservate per diversi anni senza perdere il volume di idrogeno e senza ridurre la loro potenza.
La cella a combustibile è progettata per scienziati e ricercatori, forze dell'ordine, soccorritori, proprietari di barche e porticcioli e chiunque altro abbia bisogno di una fonte di energia affidabile in caso di emergenza.  Puoi ottenere 12 volt o 220 volt e poi avrai abbastanza energia per far funzionare la TV, lo stereo, il frigorifero, la caffettiera, il bollitore, l'aspirapolvere, il trapano, il microfornello e altri elettrodomestici.
Puoi ottenere 12 volt o 220 volt e poi avrai abbastanza energia per far funzionare la TV, lo stereo, il frigorifero, la caffettiera, il bollitore, l'aspirapolvere, il trapano, il microfornello e altri elettrodomestici.
Le celle a combustibile Hydrocell possono essere vendute come unità singola o in batterie da 2-4 celle. Due o quattro elementi possono essere combinati per aumentare la potenza o aumentare l'amperaggio. 

TEMPO DI FUNZIONAMENTO DEGLI ELETTRODOMESTICI CON CELLE A COMBUSTIBILE
| Apparecchi elettrici | Tempo di funzionamento giornaliero (min.) | Necessario potenza al giorno (Wh) | Tempo di funzionamento con celle a combustibile |
|||
| Bollitore elettrico | ||||||
| Caffettiera | ||||||
| Microlastra | ||||||
| tv | ||||||
| 1 lampadina da 60W | ||||||
| 1 lampadina da 75W | ||||||
| 3 lampadine da 60W | ||||||
| Computer portatile | ||||||
| Frigo | ||||||
| Lampada a risparmio energetico | ||||||
* - operazione continua
Le celle a combustibile vengono completamente caricate in speciali stazioni di idrogeno. Ma cosa succede se viaggi lontano da loro e non c'è modo di ricaricarli? Soprattutto per questi casi, gli specialisti Alfaintek hanno sviluppato cilindri per lo stoccaggio dell'idrogeno, con i quali le celle a combustibile funzioneranno molto più a lungo.
Sono disponibili due tipi di bombole: NS-MN200 e NS-MN1200.La NS-MN200 assemblata è poco più grande di una lattina di Coca-Cola, contiene 230 litri di idrogeno, che corrispondono a 40Ah (12V), e pesa solo 2,5 kg. .La bombola ad idruro metallico NS-MN1200 contiene 1200 litri di idrogeno, che corrispondono a 220Ah (12V). Il peso del cilindro è di 11 kg.
La tecnica dell'idruro metallico è un modo semplice e sicuro per immagazzinare, trasportare e utilizzare l'idrogeno. Se immagazzinato come idruro metallico, l'idrogeno è sotto forma di composto chimico anziché gassoso. Questo metodo consente di ottenere una densità di energia sufficientemente elevata. Il vantaggio dell'utilizzo dell'idruro metallico è che la pressione all'interno della bombola è di soli 2-4 bar.La bombola non è esplosiva e può essere conservata per anni senza ridurre il volume della sostanza. Poiché l'idrogeno è immagazzinato come idruro metallico, la purezza dell'idrogeno ottenuto dalla bombola è molto elevata, pari al 99,999%. I cilindri per lo stoccaggio dell'idrogeno a idruro metallico possono essere utilizzati non solo con le celle a combustibile HC 100,200,400, ma anche in altri casi in cui è necessario idrogeno puro. I cilindri possono essere facilmente collegati a una cella a combustibile o altro dispositivo utilizzando un connettore ad attacco rapido e un tubo flessibile.
È un peccato che queste celle a combustibile non siano vendute in Russia. Ma tra la nostra popolazione ci sono tantissime persone che ne hanno bisogno. Bene, aspetteremo e vedremo, e vedrai, ne avremo alcuni. Nel frattempo acquisteremo le lampadine a risparmio energetico imposte dallo Stato.
PS Sembra che l'argomento sia finalmente caduto nell'oblio. Dopo così tanti anni dalla stesura di questo articolo, non ne è venuto fuori nulla. Forse non guardo dappertutto, certo, ma ciò che attira la mia attenzione non è per niente gradevole. La tecnologia e l’idea sono buone, ma non hanno ancora trovato alcuno sviluppo.
lavent.ru
La cella a combustibile è un futuro che inizia oggi!
L’inizio del 21° secolo considera l’ecologia come una delle sfide globali più importanti. E la prima cosa a cui prestare attenzione nelle condizioni attuali è la ricerca e l'utilizzo di fonti energetiche alternative. Sono loro che sono in grado di prevenire l’inquinamento del nostro ambiente e di abbandonare completamente il continuo aumento dei prezzi dei combustibili a base di idrocarburi.
 Già oggi fonti energetiche come le celle solari e le turbine eoliche hanno trovato applicazione. Ma, sfortunatamente, il loro svantaggio è associato alla dipendenza dal tempo, dalla stagione e dall'ora del giorno. Per questo motivo il loro utilizzo nell'astronautica, nell'aeronautica e nell'industria automobilistica viene gradualmente abbandonato e per l'uso stazionario sono dotati di fonti di energia secondarie: le batterie.
Già oggi fonti energetiche come le celle solari e le turbine eoliche hanno trovato applicazione. Ma, sfortunatamente, il loro svantaggio è associato alla dipendenza dal tempo, dalla stagione e dall'ora del giorno. Per questo motivo il loro utilizzo nell'astronautica, nell'aeronautica e nell'industria automobilistica viene gradualmente abbandonato e per l'uso stazionario sono dotati di fonti di energia secondarie: le batterie.
Tuttavia, la soluzione migliore è una cella a combustibile, poiché non richiede una ricarica costante di energia. Si tratta di un dispositivo in grado di elaborare e convertire vari tipi di carburante (benzina, alcool, idrogeno, ecc.) direttamente in energia elettrica.
Una cella a combustibile funziona secondo il seguente principio: dall'esterno viene fornito il carburante, che viene ossidato dall'ossigeno, e l'energia rilasciata viene convertita in elettricità. Questo principio di funzionamento garantisce un funzionamento quasi eterno.
 Dalla fine del 19° secolo, gli scienziati hanno studiato la cella a combustibile stessa e ne hanno sviluppato costantemente nuove modifiche. Quindi oggi, a seconda delle condizioni operative, esistono modelli alcalini o alcalini (AFC), boroidrati diretti (DBFC), elettrogalvanici (EGFC), metanolo diretto (DMFC), zinco-aria (ZAFC), microbici (MFC), modelli sono noti anche composti a base di acido formico (DFAFC) e idruri metallici (MHFC).
Dalla fine del 19° secolo, gli scienziati hanno studiato la cella a combustibile stessa e ne hanno sviluppato costantemente nuove modifiche. Quindi oggi, a seconda delle condizioni operative, esistono modelli alcalini o alcalini (AFC), boroidrati diretti (DBFC), elettrogalvanici (EGFC), metanolo diretto (DMFC), zinco-aria (ZAFC), microbici (MFC), modelli sono noti anche composti a base di acido formico (DFAFC) e idruri metallici (MHFC).
Una delle più promettenti è la cella a combustibile a idrogeno. L'uso dell'idrogeno nelle centrali elettriche è accompagnato da un significativo rilascio di energia e lo scarico di tale dispositivo è puro vapore acqueo o acqua potabile, che non rappresenta alcuna minaccia per l'ambiente.
 I test di successo di celle a combustibile di questo tipo su veicoli spaziali hanno recentemente suscitato un notevole interesse tra i produttori di dispositivi elettronici e varie apparecchiature. Pertanto, l'azienda PolyFuel ha presentato una cella a combustibile a idrogeno in miniatura per laptop. Ma il costo troppo elevato di un tale dispositivo e le difficoltà nel rifornimento senza ostacoli ne limitano la produzione industriale e l’ampia distribuzione. Honda produce anche celle a combustibile per autoveicoli da oltre 10 anni. Tuttavia, questo tipo di trasporto non è in vendita, ma solo per l'uso ufficiale dei dipendenti dell'azienda. Le auto sono sotto la supervisione di ingegneri.
I test di successo di celle a combustibile di questo tipo su veicoli spaziali hanno recentemente suscitato un notevole interesse tra i produttori di dispositivi elettronici e varie apparecchiature. Pertanto, l'azienda PolyFuel ha presentato una cella a combustibile a idrogeno in miniatura per laptop. Ma il costo troppo elevato di un tale dispositivo e le difficoltà nel rifornimento senza ostacoli ne limitano la produzione industriale e l’ampia distribuzione. Honda produce anche celle a combustibile per autoveicoli da oltre 10 anni. Tuttavia, questo tipo di trasporto non è in vendita, ma solo per l'uso ufficiale dei dipendenti dell'azienda. Le auto sono sotto la supervisione di ingegneri.
Molte persone si chiedono se sia possibile assemblare una cella a combustibile con le proprie mani. Dopotutto, un vantaggio significativo di un dispositivo fatto in casa sarà un investimento minore, a differenza di un modello industriale. Per il modello in miniatura avrete bisogno di 30 cm di filo di nichel rivestito di platino, un piccolo pezzo di plastica o legno, una clip per batteria da 9 volt e la batteria stessa, nastro adesivo trasparente, un bicchiere d'acqua e un voltmetro. Un tale dispositivo ti consentirà di vedere e comprendere l'essenza del lavoro, ma, ovviamente, non sarà possibile generare elettricità per l'auto.
fb.ru
Celle a combustibile a idrogeno: un po' di storia | Idrogeno
Al giorno d’oggi, il problema della carenza delle risorse energetiche tradizionali e del deterioramento dell’ecologia del pianeta nel suo insieme a causa del loro utilizzo è particolarmente acuto. Ecco perché, recentemente, significative risorse finanziarie e intellettuali sono state spese per lo sviluppo di sostituti potenzialmente promettenti dei combustibili idrocarburici. L'idrogeno potrebbe diventare un tale sostituto in un futuro molto prossimo, poiché il suo utilizzo nelle centrali elettriche è accompagnato dal rilascio di una grande quantità di energia e lo scarico è vapore acqueo, cioè non rappresenta un pericolo per l'ambiente.

Nonostante alcune difficoltà tecniche ancora esistenti nell’implementazione delle celle a combustibile basate sull’idrogeno, molti produttori di automobili hanno apprezzato la promessa della tecnologia e stanno già sviluppando attivamente prototipi di automobili di serie in grado di utilizzare l’idrogeno come carburante principale. Già nel duemilaundici Daimler AG presentò modelli Mercedes-Benz concettuali dotati di centrali elettriche a idrogeno. Inoltre, la società coreana Hyndai ha annunciato ufficialmente che non intende più sviluppare auto elettriche, ma concentrerà tutti i suoi sforzi sullo sviluppo di un'auto a idrogeno a prezzi accessibili.
Nonostante il fatto che l'idea stessa di utilizzare l'idrogeno come combustibile non sia folle per molti, la maggior parte non ha idea di come funzionino le celle a combustibile che utilizzano l'idrogeno e di cosa ci sia di così straordinario in esse.
Per comprendere l’importanza della tecnologia, suggeriamo di guardare alla storia delle celle a combustibile a idrogeno.
La prima persona a descrivere il potenziale dell'uso dell'idrogeno in una cella a combustibile fu un tedesco, Christian Friedrich. Nel 1838 pubblicò il suo lavoro su una famosa rivista scientifica dell'epoca.
L'anno successivo, un giudice di Uhls, Sir William Robert Grove, creò un prototipo di una batteria a idrogeno funzionante. Tuttavia, la potenza del dispositivo era troppo piccola anche per gli standard di quel tempo, quindi il suo utilizzo pratico era fuori discussione.
Per quanto riguarda il termine “cella a combustibile”, deve la sua esistenza agli scienziati Ludwig Mond e Charles Langer, che nel 1889 tentarono di creare una cella a combustibile funzionante con aria e gas di cokeria. Secondo altre fonti, il termine fu usato per la prima volta da William White Jaques, che per primo decise di utilizzare l'acido fosforico in un elettrolita.
Negli anni '20 in Germania furono condotti numerosi studi che portarono alla scoperta delle celle a combustibile a ossido solido e dei modi per utilizzare il ciclo del carbonato. È interessante notare che queste tecnologie sono effettivamente utilizzate nel nostro tempo.
Nel 1932, l'ingegnere Francis T Bacon iniziò a lavorare sulla ricerca diretta sulle celle a combustibile basate sull'idrogeno. Prima di lui, gli scienziati utilizzavano uno schema consolidato: gli elettrodi di platino porosi venivano posti nell'acido solforico. L'ovvio svantaggio di un tale schema risiede, prima di tutto, nel suo costo elevato ingiustificato dovuto all'uso del platino. Inoltre, l’uso dell’acido solforico caustico rappresentava una minaccia per la salute e talvolta anche per la vita dei ricercatori. Bacon decise di ottimizzare il circuito e sostituì il platino con il nichel e utilizzò una composizione alcalina come elettrolita.
Grazie al lavoro produttivo per migliorare la sua tecnologia, Bacon già nel 1959 presentò al grande pubblico la sua originale cella a combustibile a idrogeno, che produceva 5 kW e poteva alimentare una saldatrice. Ha chiamato il dispositivo presentato "Bacon Cell".
Nell'ottobre dello stesso anno fu creato un trattore unico che funzionava a idrogeno e produceva venti cavalli.
Negli anni sessanta del XX secolo, l'azienda americana General Electric sviluppò lo schema elaborato da Bacon e lo applicò ai programmi spaziali Apollo e Gemini della NASA. Gli esperti della NASA sono giunti alla conclusione che l'uso di un reattore nucleare è troppo costoso, tecnicamente difficile e pericoloso. Inoltre, abbiamo dovuto abbandonare l'uso delle batterie insieme ai pannelli solari a causa delle loro grandi dimensioni. La soluzione al problema erano le celle a combustibile a idrogeno, in grado di fornire energia al veicolo spaziale e acqua pulita al suo equipaggio.

Il primo autobus che utilizzava l’idrogeno come carburante fu costruito nel 1993. E i prototipi di autovetture alimentate da celle a combustibile a idrogeno sono stati presentati già nel 1997 da marchi automobilistici globali come Toyota e Daimler Benz.
È un po’ strano che il promettente carburante ecologico, venduto quindici anni fa nelle automobili, non sia ancora diventato diffuso. Ci sono molte ragioni per questo, le principali forse sono politiche e la richiesta di creare infrastrutture adeguate. Speriamo che l'idrogeno continui a dire la sua e diventi un concorrente significativo per le auto elettriche.(odnaknopka)
Energycraft.org
Creato il 14/07/2012 20:44 Autore: Alexey NorkinLa nostra società materiale senza energia non solo non può svilupparsi, ma nemmeno esistere. Da dove viene l'energia? Fino a poco tempo fa l'uomo utilizzava un solo modo per ottenerlo: si lottava con la natura, bruciando i trofei ottenuti nelle fornaci dei focolari domestici prima, poi delle locomotive a vapore e delle potenti centrali termoelettriche.
Non ci sono etichette sui chilowattora consumati dall’uomo medio moderno che indichino quanti anni la natura ha lavorato affinché l’uomo civilizzato potesse godere dei benefici della tecnologia, e quanti anni deve ancora lavorare per appianare i danni causati all’uomo. lei da una tale civiltà. Tuttavia, nella società cresce la consapevolezza che prima o poi l’idillio illusorio finirà. Sempre più persone stanno inventando modi per fornire energia per i propri bisogni con il minimo danno alla natura.
Le celle a combustibile a idrogeno sono il Santo Graal dell’energia pulita. Elaborano l'idrogeno, uno degli elementi comuni della tavola periodica, e rilasciano solo acqua, la sostanza più comune sul pianeta. Il quadro roseo è rovinato dalla mancanza di accesso delle persone all’idrogeno come sostanza. Ce n'è in abbondanza, ma solo allo stato legato, ed estrarlo è molto più difficile che pompare petrolio dalle profondità o estrarre carbone.
Una delle opzioni per la produzione pulita ed ecologica di idrogeno sono le celle a combustibile microbiche (MTB), che utilizzano microrganismi per decomporre l’acqua in ossigeno e idrogeno. Anche qui non tutto fila liscio. I microbi svolgono un ottimo lavoro producendo carburante pulito, ma per raggiungere l’efficienza richiesta nella pratica, la MTB richiede un catalizzatore che acceleri una delle reazioni chimiche del processo.
Questo catalizzatore è il prezioso metallo platino, il cui costo rende economicamente ingiustificato e praticamente impossibile l'utilizzo della MTB.
Gli scienziati dell'Università del Wisconsin-Milwaukee hanno trovato un sostituto del costoso catalizzatore. Invece del platino, hanno proposto di utilizzare nanotubi economici costituiti da una combinazione di carbonio, azoto e ferro. Il nuovo catalizzatore è costituito da barre di grafite con azoto incorporato nello strato superficiale e nuclei di carburo di ferro. Durante tre mesi di test del nuovo prodotto, il catalizzatore ha dimostrato capacità superiori a quelle del platino. Il funzionamento dei nanotubi si è rivelato più stabile e controllabile.
E, soprattutto, il frutto dell'ingegno degli scienziati universitari è molto più economico. Pertanto, il costo dei catalizzatori al platino è pari a circa il 60% del costo dell’MTB, mentre il costo dei nanotubi è entro il 5% del loro prezzo attuale.
Secondo il creatore dei nanotubi catalitici, il professor Junhong Chen: “Le celle a combustibile possono convertire direttamente il carburante in elettricità. Insieme, l’energia elettrica da fonti rinnovabili può essere fornita dove è necessaria in modo pulito, efficiente e sostenibile”.
Il professor Chen e il suo team di ricercatori stanno ora studiando le esatte caratteristiche del catalizzatore. Il loro obiettivo è dare alla loro invenzione un focus pratico, per renderla adatta alla produzione e all'uso di massa.
Basato su materiali di Gizmag
www.facepla.net
Celle a combustibile a idrogeno e sistemi energetici
Un’auto alimentata ad acqua potrebbe presto diventare realtà e celle a combustibile a idrogeno verranno installate in molte case…
La tecnologia delle celle a combustibile a idrogeno non è nuova. Tutto iniziò nel 1776, quando Henry Cavendish scoprì per la prima volta l'idrogeno sciogliendo i metalli in acidi diluiti. La prima cella a combustibile a idrogeno fu inventata già nel 1839 da William Grove. Da allora, le celle a combustibile a idrogeno sono state gradualmente migliorate e ora vengono installate nelle navette spaziali, fornendo loro energia e fungendo da fonte d’acqua. Oggi, la tecnologia delle celle a combustibile a idrogeno è sul punto di raggiungere il mercato di massa, nelle automobili, nelle case e nei dispositivi portatili.
In una cella a combustibile a idrogeno, l'energia chimica (sotto forma di idrogeno e ossigeno) viene convertita direttamente (senza combustione) in energia elettrica. Una cella a combustibile è costituita da un catodo, elettrodi e un anodo. L'idrogeno viene alimentato all'anodo, dove viene separato in protoni ed elettroni. I protoni e gli elettroni hanno percorsi diversi verso il catodo. I protoni si muovono attraverso l'elettrodo fino al catodo e gli elettroni passano attorno alle celle a combustibile per raggiungere il catodo. Questo movimento crea energia elettrica successivamente utilizzabile. D'altro canto, i protoni e gli elettroni dell'idrogeno si combinano con l'ossigeno per formare acqua.
Gli elettrolizzatori sono un modo per estrarre l'idrogeno dall'acqua. Il processo è sostanzialmente l’opposto di ciò che accade con una cella a combustibile a idrogeno. L'elettrolizzatore è costituito da un anodo, una cella elettrochimica e un catodo. Acqua e tensione vengono applicate all'anodo, che divide l'acqua in idrogeno e ossigeno. L'idrogeno passa attraverso la cella elettrochimica fino al catodo e l'ossigeno viene fornito direttamente al catodo. Da lì, l’idrogeno e l’ossigeno possono essere estratti e immagazzinati. Nei periodi in cui non è necessaria la produzione di elettricità, il gas accumulato può essere rimosso dall’impianto di stoccaggio e fatto passare nuovamente attraverso la cella a combustibile.
Questo sistema utilizza l’idrogeno come carburante, motivo per cui esistono molti miti sulla sua sicurezza. Dopo l'esplosione dell'Hindenburg, molte persone lontane dalla scienza e persino alcuni scienziati iniziarono a credere che l'uso dell'idrogeno fosse molto pericoloso. Tuttavia, recenti ricerche hanno dimostrato che la causa di questa tragedia era legata al tipo di materiale utilizzato nella costruzione e non all’idrogeno pompato all’interno. Dopo aver testato la sicurezza dello stoccaggio dell’idrogeno, si è scoperto che immagazzinare l’idrogeno nelle celle a combustibile è più sicuro che immagazzinare la benzina nel serbatoio del carburante di un’auto.
Quanto costano le moderne celle a combustibile a idrogeno? Le aziende attualmente offrono sistemi di carburante a idrogeno che producono energia per circa 3.000 dollari per kilowatt. Ricerche di mercato hanno stabilito che quando il costo scenderà a 1.500 dollari per kilowatt, i consumatori nel mercato energetico di massa saranno pronti a passare a questo tipo di carburante.
I veicoli a celle a combustibile a idrogeno sono ancora più costosi dei veicoli con motore a combustione interna, ma i produttori stanno esplorando modi per portare il prezzo a livelli comparabili. In alcune aree remote dove non ci sono linee elettriche, utilizzare l’idrogeno come combustibile o alimentare la casa in modo indipendente potrebbe essere più economico in questo momento rispetto, ad esempio, alla costruzione di infrastrutture per le fonti energetiche tradizionali.
Perché le celle a combustibile a idrogeno non sono ancora ampiamente utilizzate? Al momento, il loro elevato costo rappresenta il principale problema per la diffusione delle celle a combustibile a idrogeno. I sistemi di alimentazione a idrogeno semplicemente non hanno una domanda di massa al momento. Tuttavia, la scienza non si ferma e nel prossimo futuro un’auto che corre sull’acqua potrebbe diventare una realtà reale.
www.tesla-tehnika.biz
Un’auto alimentata ad acqua potrebbe presto diventare realtà e celle a combustibile a idrogeno verranno installate in molte case…
Tecnologia dell'idrogeno celle a combustibile non nuovo. Tutto iniziò nel 1776, quando Henry Cavendish scoprì per la prima volta l'idrogeno sciogliendo i metalli in acidi diluiti. La prima cella a combustibile a idrogeno fu inventata già nel 1839 da William Grove. Da allora, le celle a combustibile a idrogeno sono state gradualmente migliorate e ora vengono installate nelle navette spaziali, fornendo loro energia e fungendo da fonte d’acqua. Oggi, la tecnologia delle celle a combustibile a idrogeno è sul punto di raggiungere il mercato di massa, nelle automobili, nelle case e nei dispositivi portatili.
In una cella a combustibile a idrogeno, l'energia chimica (sotto forma di idrogeno e ossigeno) viene convertita direttamente (senza combustione) in energia elettrica. Una cella a combustibile è costituita da un catodo, elettrodi e un anodo. L'idrogeno viene alimentato all'anodo, dove viene separato in protoni ed elettroni. I protoni e gli elettroni hanno percorsi diversi verso il catodo. I protoni si muovono attraverso l'elettrodo fino al catodo e gli elettroni passano attorno alle celle a combustibile per raggiungere il catodo. Questo movimento crea energia elettrica successivamente utilizzabile. D'altro canto, i protoni e gli elettroni dell'idrogeno si combinano con l'ossigeno per formare acqua.
Gli elettrolizzatori sono un modo per estrarre l'idrogeno dall'acqua. Il processo è sostanzialmente l’opposto di ciò che accade con una cella a combustibile a idrogeno. L'elettrolizzatore è costituito da un anodo, una cella elettrochimica e un catodo. Acqua e tensione vengono applicate all'anodo, che divide l'acqua in idrogeno e ossigeno. L'idrogeno passa attraverso la cella elettrochimica fino al catodo e l'ossigeno viene fornito direttamente al catodo. Da lì, l’idrogeno e l’ossigeno possono essere estratti e immagazzinati. Nei periodi in cui non è necessaria la produzione di elettricità, il gas accumulato può essere rimosso dall’impianto di stoccaggio e fatto passare nuovamente attraverso la cella a combustibile.
Questo sistema utilizza l’idrogeno come carburante, motivo per cui esistono molti miti sulla sua sicurezza. Dopo l'esplosione dell'Hindenburg, molte persone lontane dalla scienza e persino alcuni scienziati iniziarono a credere che l'uso dell'idrogeno fosse molto pericoloso. Tuttavia, recenti ricerche hanno dimostrato che la causa di questa tragedia era legata al tipo di materiale utilizzato nella costruzione e non all’idrogeno pompato all’interno. Dopo aver testato la sicurezza dello stoccaggio dell’idrogeno, si è scoperto che immagazzinare l’idrogeno nelle celle a combustibile è più sicuro che conservare la benzina nel serbatoio di un'auto.
Quanto costano le moderne celle a combustibile a idrogeno?? Le aziende stanno attualmente offrendo idrogeno sistemi di alimentazione produrre energia ad un costo di circa 3.000 dollari per kilowatt. Ricerche di mercato hanno stabilito che quando il costo scenderà a 1.500 dollari per kilowatt, i consumatori nel mercato energetico di massa saranno pronti a passare a questo tipo di carburante.
I veicoli a celle a combustibile a idrogeno sono ancora più costosi dei veicoli con motore a combustione interna, ma i produttori stanno esplorando modi per portare il prezzo a livelli comparabili. In alcune aree remote dove non ci sono linee elettriche, utilizzare l’idrogeno come combustibile o alimentare la casa in modo indipendente potrebbe essere più economico in questo momento rispetto, ad esempio, alla costruzione di infrastrutture per le fonti energetiche tradizionali.
Perché le celle a combustibile a idrogeno non sono ancora ampiamente utilizzate? Al momento, il loro elevato costo rappresenta il principale problema per la diffusione delle celle a combustibile a idrogeno. I sistemi di alimentazione a idrogeno semplicemente non hanno una domanda di massa al momento. Tuttavia, la scienza non si ferma e nel prossimo futuro un’auto che corre sull’acqua potrebbe diventare una realtà reale.
Fabbricazione, assemblaggio, collaudo e collaudo di celle/celle a combustibile (idrogeno).
Prodotto in stabilimenti negli Stati Uniti e in Canada
Celle/celle a combustibile (idrogeno).
La società Intech GmbH / LLC Intech GmbH è presente sul mercato dei servizi di ingegneria dal 1997, è il fornitore ufficiale a lungo termine di varie apparecchiature industriali e porta alla vostra attenzione diversi elementi/celle combustibili (idrogeno).
Una cella a combustibile lo è
Vantaggi delle celle/celle a combustibile
Una cella/cella a combustibile è un dispositivo che produce in modo efficiente corrente continua e calore da un combustibile ricco di idrogeno attraverso una reazione elettrochimica.
Una cella a combustibile è simile a una batteria in quanto produce corrente continua attraverso una reazione chimica. La cella a combustibile comprende un anodo, un catodo e un elettrolita. Tuttavia, a differenza delle batterie, le celle a combustibile non possono immagazzinare energia elettrica e non si scaricano né richiedono elettricità per ricaricarsi. Le celle/celle a combustibile possono produrre continuamente elettricità finché dispongono di una fornitura di carburante e aria.
A differenza di altri generatori di energia, come motori a combustione interna o turbine alimentate a gas, carbone, olio combustibile, ecc., le celle/celle a combustibile non bruciano carburante. Ciò significa niente rotori rumorosi ad alta pressione, nessun rumore di scarico forte, nessuna vibrazione. Le celle a combustibile producono elettricità attraverso una reazione elettrochimica silenziosa. Un'altra caratteristica delle celle a combustibile è che convertono l'energia chimica del combustibile direttamente in elettricità, calore e acqua.
Le celle a combustibile sono altamente efficienti e non producono grandi quantità di gas serra come anidride carbonica, metano e protossido di azoto. Gli unici prodotti emessi durante il funzionamento sono acqua sotto forma di vapore e una piccola quantità di anidride carbonica, che non viene rilasciata affatto se come combustibile viene utilizzato idrogeno puro. Gli elementi/celle di combustibile vengono assemblati in gruppi e quindi in singoli moduli funzionali.
Storia dello sviluppo delle celle a combustibile/celle
Negli anni '50 e '60, una delle sfide più urgenti per le celle a combustibile nacque dalla necessità da parte della NASA (National Aeronautics and Space Administration) di fonti di energia per le missioni spaziali di lunga durata. La cella a combustibile alcalina della NASA utilizza idrogeno e ossigeno come combustibile combinando i due elementi chimici in una reazione elettrochimica. Il risultato sono tre utili sottoprodotti della reazione nel volo spaziale: elettricità per alimentare il veicolo spaziale, acqua per bere e sistemi di raffreddamento e calore per riscaldare gli astronauti.
La scoperta delle celle a combustibile risale all'inizio del XIX secolo. La prima prova dell’effetto delle celle a combustibile fu ottenuta nel 1838.
Alla fine degli anni '30 iniziarono i lavori sulle celle a combustibile con un elettrolita alcalino e nel 1939 fu costruita una cella che utilizzava elettrodi nichelati ad alta pressione. Durante la seconda guerra mondiale furono sviluppate celle a combustibile per i sottomarini della Marina britannica e nel 1958 fu introdotto un gruppo di combustibile costituito da celle a combustibile alcaline con un diametro di poco più di 25 cm.
L’interesse aumentò negli anni ’50 e ’60, e anche negli anni ’80, quando il mondo industriale sperimentò una carenza di combustibili petroliferi. Nello stesso periodo, anche i paesi del mondo si sono preoccupati del problema dell’inquinamento atmosferico e hanno considerato modi per generare elettricità in modo rispettoso dell’ambiente. La tecnologia delle celle a combustibile è attualmente in fase di rapido sviluppo.
Principio di funzionamento delle celle/celle a combustibile
Le celle/celle a combustibile producono elettricità e calore grazie a una reazione elettrochimica che avviene utilizzando un elettrolita, un catodo e un anodo.

L'anodo e il catodo sono separati da un elettrolita che conduce protoni. Dopo che l'idrogeno arriva all'anodo e l'ossigeno al catodo, inizia una reazione chimica, a seguito della quale elettricità, calore e acqua.
Nel catalizzatore dell'anodo, l'idrogeno molecolare si dissocia e perde elettroni. Gli ioni idrogeno (protoni) vengono condotti attraverso l'elettrolita al catodo, mentre gli elettroni vengono fatti passare attraverso l'elettrolita e passano attraverso la parte esterna circuito elettrico, creando corrente continua che può essere utilizzata per alimentare le apparecchiature. Nel catalizzatore del catodo, una molecola di ossigeno si combina con un elettrone (fornito dalle comunicazioni esterne) e un protone in entrata, e forma acqua, che è l'unico prodotto della reazione (sotto forma di vapore e/o liquido).
Di seguito è riportata la reazione corrispondente:
Reazione all'anodo: 2H 2 => 4H+ + 4e -
Reazione al catodo: O 2 + 4H+ + 4e - => 2H 2 O
Reazione generale dell'elemento: 2H 2 + O 2 => 2H 2 O
Tipi e varietà di elementi/celle di combustibile
Così come esistono diversi tipi di motori a combustione interna, esistono diversi tipi di celle a combustibile: la scelta del giusto tipo di cella a combustibile dipende dalla sua applicazione.

Le celle a combustibile si dividono in ad alta temperatura e a bassa temperatura. Le celle a combustibile a bassa temperatura richiedono idrogeno relativamente puro come combustibile. Ciò significa spesso che è necessaria la lavorazione del combustibile per convertire il combustibile primario (come il gas naturale) in idrogeno puro. Questo processo consuma energia aggiuntiva e richiede attrezzature speciali. Le celle a combustibile ad alta temperatura non necessitano di questa procedura aggiuntiva poiché possono “convertire internamente” il carburante a temperature elevate, il che significa che non è necessario investire nelle infrastrutture per l’idrogeno.
Celle a combustibile/celle a carbonato fuso (MCFC)

Le celle a combustibile con elettrolita a carbonato fuso sono celle a combustibile ad alta temperatura. L'elevata temperatura operativa consente l'uso diretto del gas naturale senza processore di carburante e gas a basso consumo valore calorico carburante processi di produzione e da altre fonti.
Il funzionamento dell'RCFC è diverso da quello delle altre celle a combustibile. Queste celle utilizzano un elettrolita costituito da una miscela di sali di carbonato fusi. Attualmente vengono utilizzate due tipologie di miscele: carbonato di litio e carbonato di potassio oppure carbonato di litio e carbonato di sodio. Per sciogliere i sali di carbonato e ottenere un elevato grado di mobilità ionica nell'elettrolita, le celle a combustibile con elettrolita di carbonato fuso funzionano a temperature elevate (650°C). L'efficienza varia tra il 60 e l'80%.
Quando riscaldati ad una temperatura di 650°C, i sali diventano un conduttore per gli ioni carbonato (CO 3 2-). Questi ioni passano dal catodo all'anodo, dove si combinano con l'idrogeno per formare acqua, anidride carbonica ed elettroni liberi. Questi elettroni vengono rimandati attraverso un circuito elettrico esterno al catodo, generando corrente elettrica e calore come sottoprodotto.
Reazione all'anodo: CO 3 2- + H 2 => H 2 O + CO 2 + 2e -
Reazione al catodo: CO 2 + 1/2O 2 + 2e - => CO 3 2-
Reazione generale dell'elemento: H 2 (g) + 1/2O 2 (g) + CO 2 (catodo) => H 2 O (g) + CO 2 (anodo)
Le elevate temperature operative delle celle a combustibile con elettrolita a carbonato fuso presentano alcuni vantaggi. A temperature elevate avviene il reforming interno gas naturale, eliminando la necessità di un processore di carburante. Inoltre, i vantaggi includono la possibilità di utilizzare materiali da costruzione standard come lamiere di acciaio inossidabile e catalizzatore di nichel sugli elettrodi. Il calore di scarto può essere utilizzato per generare vapore ad alta pressione per una varietà di scopi industriali e commerciali.
Anche le elevate temperature di reazione nell'elettrolita hanno i loro vantaggi. L'uso di temperature elevate richiede molto tempo per raggiungere condizioni operative ottimali e il sistema risponde più lentamente alle variazioni del consumo energetico. Queste caratteristiche consentono l'utilizzo di impianti di celle a combustibile con elettrolita a carbonato fuso in condizioni di potenza costante. Le alte temperature impediscono al monossido di carbonio di danneggiare la cella a combustibile.
Le celle a combustibile con elettrolita a carbonato fuso sono adatte per l'uso in grandi installazioni fisse. Vengono prodotte commercialmente centrali termoelettriche con una potenza elettrica di produzione di 3,0 MW. Sono in fase di sviluppo impianti con potenza in uscita fino a 110 MW.
Celle/celle a combustibile ad acido fosforico (PAFC)

Le celle a combustibile ad acido fosforico (ortofosforico) furono le prime celle a combustibile per uso commerciale.
Le celle a combustibile ad acido fosforico (ortofosforico) utilizzano un elettrolita a base di acido ortofosforico (H 3 PO 4) con una concentrazione fino al 100%. La conduttività ionica dell'acido fosforico è bassa alle basse temperature, per questo motivo queste celle a combustibile vengono utilizzate a temperature fino a 150–220°C.
Il portatore di carica nelle celle a combustibile di questo tipo è l'idrogeno (H+, protone). Un processo simile avviene nelle celle a combustibile con membrana a scambio protonico, in cui l'idrogeno fornito all'anodo viene suddiviso in protoni ed elettroni. I protoni viaggiano attraverso l'elettrolita e si combinano con l'ossigeno dell'aria al catodo per formare acqua. Gli elettroni vengono inviati attraverso un circuito elettrico esterno, generando così una corrente elettrica. Di seguito sono riportate le reazioni che generano corrente elettrica e calore.
Reazione all'anodo: 2H 2 => 4H + + 4e -
Reazione al catodo: O 2 (g) + 4H + + 4e - => 2 H 2 O
Reazione generale dell'elemento: 2H 2 + O 2 => 2H 2 O
L'efficienza delle celle a combustibile a base di acido fosforico (ortofosforico) è superiore al 40% nella generazione di energia elettrica. Con la produzione combinata di calore ed energia elettrica il rendimento complessivo è pari a circa l'85%. Inoltre, date le temperature operative, il calore di scarto può essere utilizzato per riscaldare l’acqua e generare vapore a pressione atmosferica.
Uno dei vantaggi di questo tipo di celle a combustibile è l'elevata prestazione delle centrali termoelettriche che utilizzano celle a combustibile a base di acido fosforico (ortofosforico) nella produzione combinata di energia termica ed elettrica. Le unità utilizzano monossido di carbonio con una concentrazione di circa l'1,5%, che amplia notevolmente la scelta del carburante. Inoltre, la CO 2 non influisce sull'elettrolita e sul funzionamento della cella a combustibile; questo tipo di cella funziona con combustibile naturale riformato. Altri vantaggi di questo tipo di cella a combustibile sono la struttura semplice, il basso grado di volatilità dell'elettrolita e la maggiore stabilità.
Vengono prodotte commercialmente centrali termoelettriche con una potenza elettrica fino a 500 kW. Gli impianti da 11 MW hanno superato i test appropriati. Sono in fase di sviluppo impianti con potenza in uscita fino a 100 MW.
Celle a combustibile a ossido solido (SOFC)
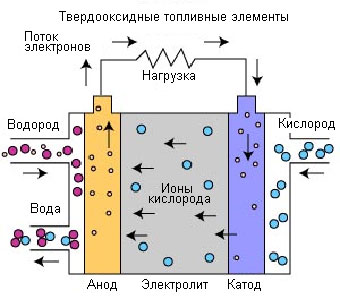
Le celle a combustibile a ossido solido sono le celle a combustibile con la temperatura operativa più elevata. La temperatura di esercizio può variare da 600°C a 1000°C, consentendo l'utilizzo di diversi tipi di carburante senza particolari pretrattamenti. Per gestire temperature così elevate, l'elettrolita utilizzato è un sottile ossido di metallo solido su una base ceramica, spesso una lega di ittrio e zirconio, che è un conduttore di ioni di ossigeno (O2-).
L'elettrolita solido fornisce una transizione sigillata del gas da un elettrodo all'altro, mentre gli elettroliti liquidi si trovano in un substrato poroso. Il portatore di carica nelle celle a combustibile di questo tipo è lo ione ossigeno (O 2-). Al catodo, le molecole di ossigeno dell'aria vengono separate in uno ione di ossigeno e quattro elettroni. Gli ioni di ossigeno passano attraverso l'elettrolita e si combinano con l'idrogeno, creando quattro elettroni liberi. Gli elettroni vengono inviati attraverso un circuito elettrico esterno, generando corrente elettrica e calore disperso.
Reazione all'anodo: 2H 2 + 2O 2- => 2H 2 O + 4e -
Reazione al catodo: O 2 + 4e - => 2O 2-
Reazione generale dell'elemento: 2H 2 + O 2 => 2H 2 O
L'efficienza dell'energia elettrica prodotta è la più alta tra tutte le celle a combustibile: circa il 60-70%. Le elevate temperature di esercizio consentono la produzione combinata di energia termica ed elettrica per generare vapore ad alta pressione. La combinazione di una cella a combustibile ad alta temperatura con una turbina consente di creare una cella a combustibile ibrida per aumentare l'efficienza della generazione di energia elettrica fino al 75%.
Le celle a combustibile a ossido solido funzionano a temperature molto elevate (600°C–1000°C), il che comporta un tempo significativo per raggiungere condizioni operative ottimali e una risposta del sistema più lenta ai cambiamenti nel consumo di energia. A temperature di esercizio così elevate non è necessario alcun convertitore per recuperare l'idrogeno dal combustibile, consentendo alla centrale termica di funzionare con combustibili relativamente impuri derivanti dalla gassificazione del carbone o dei gas di scarico, ecc. La cella a combustibile è eccellente anche per applicazioni ad alta potenza, comprese le centrali elettriche industriali e di grandi dimensioni. I moduli con una potenza elettrica in uscita di 100 kW vengono prodotti commercialmente.
Celle a combustibile/celle a ossidazione diretta del metanolo (DOMFC)
La tecnologia di utilizzo delle celle a combustibile con ossidazione diretta del metanolo sta attraversando un periodo di sviluppo attivo. Si è dimostrato efficace nel campo dell'alimentazione di telefoni cellulari, laptop e della creazione di fonti di alimentazione portatili. Questo è lo scopo a cui mira l'uso futuro di questi elementi.
La struttura delle celle a combustibile con ossidazione diretta del metanolo è simile alle celle a combustibile con membrana a scambio protonico (MEPFC), ovvero Un polimero viene utilizzato come elettrolita e uno ione idrogeno (protone) viene utilizzato come portatore di carica. Tuttavia, il metanolo liquido (CH 3 OH) si ossida in presenza di acqua all'anodo, rilasciando CO 2, ioni idrogeno ed elettroni, che vengono inviati attraverso un circuito elettrico esterno, generando così una corrente elettrica. Gli ioni idrogeno passano attraverso l'elettrolita e reagiscono con l'ossigeno dell'aria e gli elettroni del circuito esterno per formare acqua all'anodo.
Reazione all'anodo: CH 3 OH + H 2 O => CO 2 + 6H + + 6e -
Reazione al catodo: 3/2O 2 + 6 H + + 6e - => 3H 2 O
Reazione generale dell'elemento: CH 3 OH + 3/2O 2 => CO 2 + 2H 2 O
Il vantaggio di questo tipo di celle a combustibile è la loro piccola dimensione, dovuta all'utilizzo di combustibile liquido, e l'assenza della necessità di utilizzare un convertitore.
Celle/celle a combustibile alcaline (ALFC)

Le celle a combustibile alcaline sono una delle celle più efficienti utilizzate per generare elettricità, con un'efficienza di generazione di energia che arriva fino al 70%.
Le celle a combustibile alcaline utilizzano un elettrolita, una soluzione acquosa di idrossido di potassio, contenuta in una matrice porosa e stabilizzata. La concentrazione di idrossido di potassio può variare a seconda della temperatura di esercizio della cella a combustibile, che varia da 65°C a 220°C. Il portatore di carica in SHTE è lo ione ossidrile (OH -), che si sposta dal catodo all'anodo, dove reagisce con l'idrogeno, producendo acqua ed elettroni. L'acqua prodotta all'anodo ritorna al catodo, dove genera nuovamente ioni ossidrile. Come risultato di questa serie di reazioni che avvengono nella cella a combustibile, si produce elettricità e, come sottoprodotto, calore:
Reazione all'anodo: 2H 2 + 4OH - => 4H 2 O + 4e -
Reazione al catodo: O 2 + 2H 2 O + 4e - => 4 OH -
Reazione generale del sistema: 2H 2 + O 2 => 2H 2 O
Il vantaggio di SHTE è che queste celle a combustibile sono le più economiche da produrre, poiché il catalizzatore richiesto sugli elettrodi può essere una qualsiasi delle sostanze più economiche di quelle utilizzate come catalizzatori per altre celle a combustibile. Le SFC funzionano a temperature relativamente basse e sono tra le celle a combustibile più efficienti: tali caratteristiche possono di conseguenza contribuire a una generazione di energia più rapida e a un'elevata efficienza del carburante.
Una delle caratteristiche di SHTE è la sua elevata sensibilità alla CO 2, che può essere contenuta nel carburante o nell'aria. La CO 2 reagisce con l'elettrolita, lo avvelena rapidamente e riduce notevolmente l'efficienza della cella a combustibile. Pertanto, l’uso di SHTE è limitato agli spazi chiusi, come i veicoli spaziali e sottomarini, che devono funzionare con idrogeno e ossigeno puri. Inoltre, molecole come CO, H 2 O e CH4, che sono sicure per altre celle a combustibile e fungono addirittura da combustibile per alcune di esse, sono dannose per le SHFC.
Celle a combustibile con elettrolita polimerico (PEFC)
Nel caso delle celle a combustibile elettrolitiche polimeriche, la membrana polimerica è costituita da fibre polimeriche con regioni d'acqua in cui avviene la conduzione degli ioni d'acqua H2O+ (protone, rosso) che si attacca a una molecola d'acqua). Le molecole d'acqua rappresentano un problema a causa del lento scambio ionico. Pertanto è necessaria un'elevata concentrazione di acqua sia nel combustibile che agli elettrodi di uscita, limitando la temperatura di esercizio a 100°C.
Celle a combustibile/celle a combustibile solido acido (SFC)

Nelle celle a combustibile ad acido solido, l'elettrolita (CsHSO 4) non contiene acqua. La temperatura di esercizio è quindi di 100-300°C. La rotazione degli ossianioni SO 4 2- permette ai protoni (rossi) di muoversi come mostrato in figura. Tipicamente, una cella a combustibile ad acido solido è un sandwich in cui uno strato molto sottile di composto acido solido è inserito tra due elettrodi che sono strettamente premuti insieme per garantire un buon contatto. Quando riscaldato, il componente organico evapora, uscendo attraverso i pori degli elettrodi, mantenendo la capacità di contatti multipli tra il carburante (o l'ossigeno all'altra estremità dell'elemento), l'elettrolita e gli elettrodi.
Le centrali termiche ed elettriche municipali innovative ed efficienti dal punto di vista energetico sono generalmente costruite su celle a combustibile a ossido solido (SOFC), celle a combustibile con elettrolita polimerico (PEFC), celle a combustibile ad acido fosforico (PAFC), celle a combustibile con membrana a scambio protonico (PEMFC) e celle a combustibile alcaline ( ALFC). . Tipicamente hanno le seguenti caratteristiche:
Le più adatte sono le celle a combustibile a ossido solido (SOFC), che:
- operare a temperature più elevate, riducendo la necessità di costosi metalli preziosi (come il platino)
- può lavorare per vari tipi combustibili idrocarburici, principalmente gas naturale
- hanno un tempo di avvio più lungo e sono quindi più adatti per un’azione a lungo termine
- dimostrare un'elevata efficienza di generazione di energia (fino al 70%)
- Grazie alle elevate temperature di esercizio, le unità possono essere abbinate a sistemi di trasferimento del calore, portando l’efficienza complessiva del sistema all’85%
- hanno emissioni praticamente pari a zero, funzionano silenziosamente e hanno requisiti operativi bassi rispetto alle tecnologie di generazione di energia esistenti
| Tipo di cella a combustibile | Temperatura di lavoro | Efficienza nella produzione di energia | Tipo di carburante | Area di applicazione |
|---|---|---|---|---|
| RKTE | 550–700°C | 50-70% | Impianti di medie e grandi dimensioni | |
| FCTE | 100–220°C | 35-40% | Idrogeno puro | Grandi installazioni |
| MOPTE | 30-100°C | 35-50% | Idrogeno puro | Piccole installazioni |
| SOFC | 450–1000°C | 45-70% | La maggior parte dei combustibili idrocarburici | Impianti piccoli, medi e grandi |
| PEMFC | 20-90°C | 20-30% | Metanolo | Portatile |
| SHTE | 50–200°C | 40-70% | Idrogeno puro | Ricerca spaziale |
| PETE | 30-100°C | 35-50% | Idrogeno puro | Piccole installazioni |
Poiché le piccole centrali termoelettriche possono essere collegate a una rete di fornitura di gas convenzionale, le celle a combustibile non necessitano sistema separato fornitura di idrogeno. Quando si utilizzano piccole centrali termoelettriche basate su celle a combustibile a ossido solido, il calore generato può essere integrato negli scambiatori di calore per riscaldare l’acqua e l’aria di ventilazione, aumentando l’efficienza complessiva del sistema. Questa tecnologia innovativa è la più adatta per generare elettricità in modo efficiente senza la necessità di infrastrutture costose e di integrazione di strumenti complessi.
Applicazione di celle a combustibile/celle
Applicazione di celle a combustibile/celle nei sistemi di telecomunicazione
A causa della rapida proliferazione dei sistemi di comunicazione wireless in tutto il mondo, nonché dei crescenti vantaggi socioeconomici della tecnologia della telefonia mobile, la necessità di un backup energetico affidabile ed economicamente vantaggioso è diventata fondamentale. Le perdite della rete elettrica durante tutto l’anno a causa di cattive condizioni meteorologiche, catastrofi naturali o capacità di rete limitata rappresentano una sfida continua per gli operatori di rete.

Le soluzioni tradizionali di backup dell'energia per le telecomunicazioni includono batterie (cella della batteria al piombo-acido regolata da valvola) per l'alimentazione di backup a breve termine e generatori diesel e propano per l'alimentazione di backup a lungo termine. Le batterie sono una fonte di alimentazione di backup relativamente economica per 1 - 2 ore. Tuttavia, le batterie non sono adatte per l'alimentazione di backup a lungo termine perché sono costose da mantenere, diventano inaffidabili dopo lunghi periodi di utilizzo, sono sensibili alle temperature e sono pericolose per l'ambiente dopo lo smaltimento. I generatori diesel e propano possono fornire backup di energia a lungo termine. Tuttavia, i generatori possono essere inaffidabili, richiedere una manutenzione ad alta intensità di manodopera ed emettere elevati livelli di inquinanti e gas serra.
Per superare i limiti delle tradizionali soluzioni di backup energetico, è stata sviluppata l’innovativa tecnologia delle celle a combustibile ecologiche. Le celle a combustibile sono affidabili, silenziose, contengono meno parti mobili di un generatore, hanno un intervallo di temperature operative più ampio di una batteria: da -40°C a +50°C e, di conseguenza, forniscono livelli estremamente elevati di risparmio energetico. Inoltre, i costi di vita di un impianto di questo tipo sono inferiori a quelli di un generatore. I costi inferiori delle celle a combustibile derivano da una sola visita di manutenzione all'anno e da una produttività dell'impianto significativamente più elevata. In fin dei conti, la cella a combustibile è una soluzione tecnologica verde con un impatto ambientale minimo.
Gli impianti di celle a combustibile forniscono energia di backup per infrastrutture di rete di comunicazione critiche per comunicazioni wireless, permanenti e a banda larga nel sistema di telecomunicazioni, che vanno da 250 W a 15 kW, offrono molte caratteristiche innovative senza rivali:
- AFFIDABILITÀ– poche parti in movimento e nessuna scarica in modalità standby
- RISPARMIO ENERGETICO
- SILENZIO– basso livello di rumore
- SOSTENIBILITÀ– campo di funzionamento da -40°C a +50°C
- ADATTABILITÀ– installazione all'esterno e all'interno (contenitore/contenitore protettivo)
- AD ALTA POTENZA– fino a 15kW
- BASSA NECESSITÀ DI MANUTENZIONE– manutenzione annuale minima
- ECONOMICO- costo totale di proprietà interessante
- ENERGIA VERDE– basse emissioni con un impatto minimo sull’ambiente
Il sistema rileva la tensione del bus CC in ogni momento e accetta senza problemi carichi critici se la tensione del bus CC scende al di sotto di un setpoint definito dall'utente. Il sistema funziona con idrogeno, che viene fornito allo stack di celle a combustibile in due modi: da una fonte di idrogeno industriale o da un combustibile liquido composto da metanolo e acqua, utilizzando un sistema di reforming integrato.

L'elettricità è prodotta dallo stack di celle a combustibile sotto forma di corrente continua. La potenza CC viene trasferita a un convertitore, che converte la potenza CC non regolata proveniente dallo stack di celle a combustibile in potenza CC regolata di alta qualità per i carichi richiesti. Le installazioni di celle a combustibile possono fornire energia di riserva per molti giorni poiché la durata è limitata solo dalla quantità di combustibile idrogeno o metanolo/acqua disponibile.
Le celle a combustibile offrono un risparmio energetico superiore, una migliore affidabilità del sistema, prestazioni più prevedibili in un'ampia gamma di climi e una durata operativa affidabile rispetto ai pacchi batteria al piombo-acido regolati da valvole standard del settore. Anche i costi nel corso della vita sono inferiori grazie ai requisiti di manutenzione e sostituzione significativamente inferiori. Le celle a combustibile offrono vantaggi ambientali all'utente finale poiché i costi di smaltimento e i rischi di responsabilità associati alle celle al piombo sono una preoccupazione crescente.
Le prestazioni delle batterie elettriche possono essere influenzate negativamente da un'ampia gamma di fattori quali il livello di carica, la temperatura, il ciclo, la durata e altre variabili. L’energia fornita varierà a seconda di questi fattori e non è facile da prevedere. Le prestazioni di una cella a combustibile con membrana a scambio protonico (PEMFC) non sono influenzate da questi fattori e possono fornire energia critica finché è disponibile il carburante. Una maggiore prevedibilità è un vantaggio importante quando si passa alle celle a combustibile per applicazioni di alimentazione di backup mission-critical.
Le celle a combustibile generano energia solo quando viene fornito il carburante, in modo simile a un generatore a turbina a gas, ma non hanno parti mobili nell'area di generazione. Pertanto, a differenza di un generatore, non sono soggetti a rapida usura e non necessitano di costante manutenzione e lubrificazione.
Il carburante utilizzato per azionare il convertitore di carburante di lunga durata è una miscela di metanolo e acqua. Il metanolo è un carburante ampiamente disponibile e prodotto commercialmente che attualmente ha molti usi, tra cui lavavetri, bottiglie di plastica, additivi per motori e vernici a emulsione, tra gli altri. Il metanolo è facilmente trasportabile, può essere miscelato con acqua, ha una buona biodegradabilità e non contiene zolfo. Ha un punto di congelamento basso (-71°C) e non si decompone durante la conservazione a lungo termine.
Applicazione di celle a combustibile/celle nelle reti di comunicazione
Le reti di comunicazione sicure richiedono soluzioni di alimentazione di backup affidabili che possano funzionare per ore o giorni in situazioni di emergenza se la rete elettrica non è più disponibile.

Con poche parti mobili e nessuna perdita di potenza in standby, l’innovativa tecnologia delle celle a combustibile offre una soluzione interessante agli attuali sistemi di alimentazione di backup.
L'argomento più convincente a favore dell'utilizzo della tecnologia delle celle a combustibile nelle reti di comunicazione è la maggiore affidabilità e sicurezza complessiva. Durante eventi quali interruzioni di corrente, terremoti, tempeste e uragani, è importante che i sistemi continuino a funzionare e siano dotati di alimentazione di backup affidabile per un lungo periodo di tempo, indipendentemente dalla temperatura o dall'età del sistema di alimentazione di backup.
La linea di dispositivi di potenza basati su celle a combustibile è ideale per supportare reti di comunicazione classificate. Grazie ai principi di progettazione a risparmio energetico, forniscono energia di backup affidabile e rispettosa dell'ambiente con una durata prolungata (fino a diversi giorni) per l'utilizzo nella gamma di potenza da 250 W a 15 kW.
Applicazione di celle a combustibile/celle nelle reti dati

Un’alimentazione elettrica affidabile per le reti di dati, come le reti dati ad alta velocità e le dorsali in fibra ottica, è di fondamentale importanza in tutto il mondo. Le informazioni trasmesse su tali reti contengono dati critici per istituzioni come banche, compagnie aeree o centri medici. Un'interruzione di corrente in tali reti non solo rappresenta un pericolo per le informazioni trasmesse, ma, di norma, porta anche a significative perdite finanziarie. Installazioni di celle a combustibile affidabili e innovative che forniscono alimentazione di backup forniscono l'affidabilità necessaria per garantire un'alimentazione elettrica ininterrotta.
Le unità di celle a combustibile, alimentate da una miscela di combustibile liquido composta da metanolo e acqua, forniscono energia di backup affidabile con una durata estesa, fino a diversi giorni. Inoltre, queste unità hanno esigenze di manutenzione significativamente ridotte rispetto ai generatori e alle batterie, richiedendo solo una visita di manutenzione all'anno.
Caratteristiche tipiche del sito di applicazione per l'utilizzo di installazioni di celle a combustibile nelle reti di dati:
- Applicazioni con potenze assorbite da 100 W a 15 kW
- Applicazioni con requisiti di durata della batteria > 4 ore
- Ripetitori nei sistemi in fibra ottica (gerarchia dei sistemi digitali sincroni, Internet ad alta velocità, voice over IP...)
- Nodi di rete per la trasmissione dati ad alta velocità
- Nodi di trasmissione WiMAX
Le installazioni di backup dell'alimentazione con celle a combustibile offrono numerosi vantaggi per le infrastrutture di rete dati mission-critical rispetto ai tradizionali generatori a batteria o diesel, consentendo maggiori opzioni di implementazione in loco:
- La tecnologia del combustibile liquido risolve il problema del posizionamento dell’idrogeno e fornisce una potenza di riserva praticamente illimitata.
- Grazie al funzionamento silenzioso, al peso ridotto, alla resistenza alle variazioni di temperatura e al funzionamento praticamente privo di vibrazioni, le celle a combustibile possono essere installate all'esterno degli edifici, in edifici industriali/container o sui tetti.
- I preparativi per l’utilizzo del sistema in loco sono rapidi ed economici e i costi operativi sono bassi.
- Il carburante è biodegradabile e fornisce una soluzione ecologica per gli ambienti urbani.
Applicazione di celle a combustibile/celle nei sistemi di sicurezza

I sistemi di sicurezza e comunicazione degli edifici progettati con la massima attenzione sono affidabili tanto quanto l'alimentatore che li supporta. Sebbene la maggior parte dei sistemi includa un qualche tipo di sistema di backup dell'alimentazione ininterrotta per perdite di energia a breve termine, non sono in grado di gestire le interruzioni di corrente a lungo termine che possono verificarsi dopo disastri naturali o attacchi terroristici. Questo potrebbe essere un problema critico per molte agenzie aziendali e governative.
Sistemi vitali come i sistemi di monitoraggio e controllo degli accessi CCTV (lettori di carte d'identità, dispositivi di chiusura delle porte, tecnologia di identificazione biometrica, ecc.), sistemi automatici di allarme antincendio ed estinzione incendi, sistemi di controllo degli ascensori e reti di telecomunicazione, sono a rischio in assenza di alimentazione alternativa affidabile e di lunga durata.
I generatori diesel fanno molto rumore, sono difficili da posizionare e presentano problemi ben noti di affidabilità e sicurezza manutenzione tecnica. Al contrario, un’installazione di celle a combustibile che fornisce energia di riserva è silenziosa, affidabile, produce emissioni pari a zero o molto basse e può essere facilmente installata su un tetto o all’esterno di un edificio. Non si scarica né perde energia in modalità standby. Garantisce il funzionamento continuo dei sistemi critici, anche dopo che la struttura cessa l'attività e l'edificio viene sgomberato.
Le installazioni innovative di celle a combustibile proteggono i costosi investimenti in applicazioni critiche. Forniscono un'alimentazione di backup affidabile e rispettosa dell'ambiente con una durata estesa (fino a molti giorni) per l'utilizzo nella gamma di potenza da 250 W a 15 kW, combinata con numerose funzionalità senza rivali e, soprattutto, elevati livelli di risparmio energetico.
Le installazioni di backup dell'alimentazione con celle a combustibile offrono numerosi vantaggi per l'uso in applicazioni mission-critical come i sistemi di sicurezza e di controllo degli edifici rispetto alle tradizionali applicazioni alimentate a batteria o con generatori diesel. La tecnologia del combustibile liquido risolve il problema del posizionamento dell’idrogeno e fornisce una potenza di riserva praticamente illimitata.
Applicazione di celle/celle a combustibile nel riscaldamento urbano e nella produzione di energia
Le celle a combustibile a ossido solido (SOFC) forniscono centrali termiche affidabili, efficienti dal punto di vista energetico e prive di emissioni per generare elettricità e calore da gas naturale ampiamente disponibile e fonti di combustibile rinnovabile. Queste installazioni innovative sono utilizzate in una varietà di mercati, dalla produzione di energia domestica all'alimentazione remota, nonché agli alimentatori ausiliari.


Queste unità a risparmio energetico producono calore per il riscaldamento degli ambienti e dell’acqua, nonché elettricità che può essere utilizzata in casa e reimmessa nella rete. Le fonti di generazione di energia distribuita possono includere celle fotovoltaiche (solari) e turbine microeoliche. Queste tecnologie sono visibili e ampiamente conosciute, ma il loro funzionamento dipende dalle condizioni meteorologiche e non possono generare elettricità in modo costante tutto l’anno. Le centrali termoelettriche possono variare in potenza da meno di 1 kW a 6 MW o più.
Applicazione di celle a combustibile/celle nelle reti di distribuzione
Le piccole centrali termoelettriche sono progettate per funzionare in una rete di generazione di energia distribuita costituita da un gran numero di piccoli gruppi elettrogeni anziché in una centrale elettrica centralizzata.

La figura seguente mostra la perdita di efficienza della produzione di energia elettrica quando questa viene generata in una centrale termoelettrica e trasmessa alle abitazioni attraverso le tradizionali reti di trasmissione di energia attualmente in uso. Le perdite di efficienza nella generazione centralizzata comprendono le perdite della centrale elettrica, della trasmissione a bassa e alta tensione e le perdite di distribuzione.
La figura mostra i risultati dell'integrazione delle piccole centrali termoelettriche: l'energia elettrica viene generata con un rendimento di generazione fino al 60% al punto di utilizzo. Oltre a ciò, una famiglia può utilizzare il calore generato dalle celle a combustibile per riscaldare l’acqua e lo spazio, il che aumenta l’efficienza complessiva del trattamento dell’energia del combustibile e aumenta il risparmio energetico.
Utilizzo delle celle a combustibile per la tutela dell'ambiente – utilizzo del gas di petrolio associato
Uno dei compiti più importanti dell'industria petrolifera è l'utilizzo del gas di petrolio associato. I metodi esistenti per utilizzare il gas di petrolio associato presentano numerosi svantaggi, il principale dei quali è che non sono economicamente sostenibili. Il gas di petrolio associato viene bruciato, causando enormi danni all'ambiente e alla salute umana.
Centrali termiche innovative che utilizzano celle a combustibile che utilizzano gas di petrolio associato come combustibile aprono la strada a una soluzione radicale ed economicamente vantaggiosa ai problemi dell'utilizzo del gas di petrolio associato.

- Uno dei principali vantaggi degli impianti di celle a combustibile è che possono funzionare in modo affidabile e stabile con gas di petrolio associato di composizione variabile. A causa della reazione chimica senza fiamma che è alla base del funzionamento della cella a combustibile, una diminuzione della percentuale, ad esempio, di metano provoca solo una corrispondente diminuzione della potenza erogata.
- Flessibilità in relazione al carico elettrico delle utenze, cadute, picchi di carico.
- Per l'installazione e il collegamento di centrali termoelettriche a celle a combustibile, la loro implementazione non richiede costi di capitale, perché Le unità possono essere facilmente installate su siti non preparati vicino ai campi, sono facili da usare, affidabili ed efficienti.
- L'elevata automazione e il moderno controllo remoto non richiedono la presenza permanente di personale presso l'installazione.
- Semplicità e perfezione tecnica del design: l'assenza di parti mobili, attrito e sistemi di lubrificazione offre notevoli vantaggi economici dal funzionamento degli impianti di celle a combustibile.
- Consumo di acqua: nullo a temperatura ambiente fino a +30 °C e trascurabile a temperature superiori.
- Uscita acqua: nessuna.
- Inoltre, le centrali termoelettriche che utilizzano celle a combustibile non fanno rumore, non vibrano,
Le celle a combustibile sono un metodo per convertire elettrochimicamente l'energia dell'idrogeno in elettricità e l'unico sottoprodotto di questo processo è l'acqua.
Il combustibile a idrogeno attualmente utilizzato nelle celle a combustibile è tipicamente derivato dal reforming del metano a vapore (ovvero, conversione di idrocarburi utilizzando vapore e calore in metano), sebbene possano essere utilizzati approcci più ecologici, come l’elettrolisi dell’acqua utilizzando l’energia solare.
I componenti principali di una cella a combustibile sono:
- un anodo in cui avviene l'ossidazione dell'idrogeno;
- catodo, dove avviene la riduzione dell'ossigeno;
- una membrana elettrolitica polimerica attraverso la quale vengono trasportati protoni o ioni idrossido (a seconda del mezzo) - non consente il passaggio di idrogeno e ossigeno;
- campi di flusso di ossigeno e idrogeno, che sono responsabili della consegna di questi gas all'elettrodo.
Per alimentare un’auto, ad esempio, diverse celle a combustibile vengono assemblate in una batteria e la quantità di energia fornita da tale batteria dipende dall’area totale degli elettrodi e dal numero di celle in essa contenute. L'energia in una cella a combustibile viene generata come segue: l'idrogeno viene ossidato all'anodo e gli elettroni da esso vengono inviati al catodo, dove l'ossigeno viene ridotto. Gli elettroni ottenuti dall'ossidazione dell'idrogeno all'anodo hanno un potenziale chimico maggiore rispetto agli elettroni che riducono l'ossigeno al catodo. Questa differenza tra i potenziali chimici degli elettroni consente di estrarre energia dalle celle a combustibile.
Storia della creazione
La storia delle celle a combustibile risale agli anni '30, quando la prima cella a combustibile a idrogeno fu progettata da William R. Grove. Questa cella utilizzava acido solforico come elettrolita. Grove ha provato a depositare il rame da una soluzione acquosa di solfato di rame su una superficie di ferro. Notò che sotto l'influenza di una corrente di elettroni, l'acqua si scompone in idrogeno e ossigeno. In seguito a questa scoperta, Grove e il suo collaboratore Christian Schönbein, chimico dell'Università di Basilea (Svizzera), dimostrarono simultaneamente nel 1839 la possibilità di produrre energia in una cella a combustibile idrogeno-ossigeno utilizzando un elettrolita acido. Questi primi tentativi, sebbene di natura piuttosto primitiva, attirarono l'attenzione di molti dei loro contemporanei, tra cui Michael Faraday.
La ricerca sulle celle a combustibile continuò e negli anni '30 F.T. Bacon ha introdotto un nuovo componente nella cella a combustibile alcalina (un tipo di cella a combustibile): una membrana a scambio ionico per facilitare il trasporto degli ioni idrossido.
Una delle applicazioni storiche più famose delle celle a combustibile alcaline è il loro utilizzo come principale fonte di energia durante i voli spaziali del programma Apollo.
La NASA li ha scelti per la loro durata e stabilità tecnica. Hanno usato una membrana conduttrice di idrossido, che era superiore in termini di efficienza alla sua sorella a scambio di protoni.
Nei quasi due secoli trascorsi dalla creazione del primo prototipo di celle a combustibile, è stato fatto molto lavoro per migliorarle. In generale, l'energia finale ottenuta da una cella a combustibile dipende dalla cinetica della reazione redox, dalla resistenza interna della cella e dal trasferimento di massa di gas e ioni reagenti ai componenti cataliticamente attivi. Nel corso degli anni sono stati apportati molti miglioramenti all’idea originale, come ad esempio:
1) sostituzione dei fili di platino con elettrodi a base di carbonio con nanoparticelle di platino; 2) l'invenzione di membrane altamente conduttive e selettive, come Nafion, per facilitare il trasporto degli ioni; 3) combinare uno strato catalitico, ad esempio nanoparticelle di platino distribuite su una base di carbonio, con membrane a scambio ionico, ottenendo un'unità membrana-elettrodo con resistenza interna minima; 4) utilizzo e ottimizzazione dei campi di flusso per fornire idrogeno e ossigeno alla superficie catalitica, anziché diluirli direttamente in soluzione.
Questi e altri miglioramenti alla fine hanno prodotto una tecnologia abbastanza efficiente da essere utilizzata in auto come la Toyota Mirai.
Celle a combustibile con membrane a scambio idrossilico
L'Università del Delaware sta conducendo ricerche sullo sviluppo di celle a combustibile con membrana a scambio di idrossido (HEMFC). Le celle a combustibile con membrane a scambio idrossilico invece che a scambio protonico - PEMFC (celle a combustibile con membrana a scambio protonico) - affrontano meno uno dei grandi problemi delle PEMFC - il problema della stabilità del catalizzatore, poiché molti più catalizzatori di metalli di base sono stabili in condizioni alcaline rispetto a in condizioni acide. La stabilità dei catalizzatori nelle soluzioni alcaline è maggiore perché la dissoluzione dei metalli rilascia più energia a pH basso che a pH elevato. Gran parte del lavoro di questo laboratorio è dedicato anche allo sviluppo di nuovi catalizzatori anodici e catodici per le reazioni di ossidazione dell'idrogeno e di riduzione dell'ossigeno per accelerarle in modo ancora più efficace. Inoltre, il laboratorio sta sviluppando nuove membrane a scambio idrossilico, poiché la conduttività e la durata di tali membrane devono ancora essere migliorate affinché possano competere con le membrane a scambio protonico.
Cerca nuovi catalizzatori
La causa delle perdite di sovratensione nella reazione di riduzione dell'ossigeno è spiegata dalle relazioni di scala lineare tra i prodotti intermedi di questa reazione. Nel tradizionale meccanismo a quattro elettroni di questa reazione, l'ossigeno viene ridotto in sequenza, creando gli intermedi OOH*, O* e OH*, per formare infine acqua (H2O) sulla superficie catalitica. Poiché le energie di adsorbimento dei prodotti intermedi per un singolo catalizzatore sono altamente correlate tra loro, non è stato ancora trovato alcun catalizzatore che, almeno in teoria, non presenti perdite dovute a sovratensione. Sebbene la velocità di questa reazione sia bassa, la sostituzione di un ambiente acido con uno alcalino, come nell'HEMFC, non influisce particolarmente su di essa. Tuttavia, la velocità della reazione di ossidazione dell'idrogeno diminuisce di quasi la metà, e questo motiva la ricerca volta a trovare il motivo di questa diminuzione e a scoprire nuovi catalizzatori.
Vantaggi delle celle a combustibile
A differenza dei combustibili a base di idrocarburi, le celle a combustibile sono più, se non completamente, rispettose dell'ambiente e non producono gas serra a causa del loro funzionamento. Inoltre, il loro combustibile (idrogeno) è in linea di principio rinnovabile poiché può essere prodotto idrolizzando l’acqua. Pertanto, in futuro le celle a combustibile a idrogeno promettono di diventare parte integrante del processo di produzione di energia, in cui l’energia solare ed eolica vengono utilizzate per produrre idrogeno combustibile, che viene poi utilizzato nella cella a combustibile per produrre acqua. Questo chiude il ciclo e non lascia alcuna impronta di carbonio.
A differenza delle batterie ricaricabili, le celle a combustibile hanno il vantaggio di non dover essere ricaricate: possono iniziare immediatamente a fornire energia non appena è necessaria. Cioè, se vengono utilizzati, ad esempio, nel campo dei veicoli, non ci saranno quasi cambiamenti dal lato dei consumatori. A differenza dell’energia solare ed eolica, le celle a combustibile possono produrre energia costantemente e dipendono molto meno dalle condizioni esterne. A sua volta, l’energia geotermica è disponibile solo in alcune aree geografiche, mentre anche le celle a combustibile non presentano questo problema.
Le celle a combustibile a idrogeno sono tra le fonti energetiche più promettenti grazie alla loro portabilità e flessibilità di scala.
La difficoltà di immagazzinare l’idrogeno
Oltre ai problemi legati alle carenze delle attuali membrane e catalizzatori, altre sfide tecniche per le celle a combustibile riguardano lo stoccaggio e il trasporto dell’idrogeno combustibile. L'idrogeno ha un'energia specifica per unità di volume molto bassa (la quantità di energia contenuta in un'unità di volume a una determinata temperatura e pressione) e pertanto deve essere immagazzinato a una pressione molto elevata per essere utilizzato nei veicoli. Altrimenti, la dimensione del contenitore per immagazzinare la quantità necessaria di carburante sarà incredibilmente grande. A causa di queste limitazioni dello stoccaggio dell’idrogeno, sono stati fatti tentativi per trovare modi per produrre idrogeno da qualcosa di diverso dalla sua forma gassosa, come nelle celle a combustibile a idruro metallico. Tuttavia, le attuali applicazioni di celle a combustibile di consumo, come la Toyota Mirai, utilizzano idrogeno supercritico (idrogeno mantenuto a temperature superiori a 33 K e pressione superiore a 13,3 atmosfere, cioè al di sopra dei valori critici), e questa è ora l’opzione più conveniente.
Prospettive per la regione
A causa delle attuali difficoltà tecniche e delle sfide legate alla produzione di idrogeno dall’acqua utilizzando l’energia solare, la ricerca nel prossimo futuro si concentrerà probabilmente principalmente sulla ricerca di fonti alternative di idrogeno. Un’idea popolare è quella di utilizzare l’ammoniaca (nitruro di idrogeno) direttamente nella cella a combustibile al posto dell’idrogeno, o di produrre idrogeno dall’ammoniaca. La ragione di ciò è che l’ammoniaca è meno esigente in termini di pressione, il che la rende più conveniente per lo stoccaggio e lo spostamento. Inoltre, l’ammoniaca è interessante come fonte di idrogeno perché non contiene carbonio. Ciò risolve il problema dell’avvelenamento del catalizzatore dovuto alla presenza di CO nell’idrogeno prodotto dal metano.
In futuro, le celle a combustibile potrebbero avere applicazioni diffuse nella tecnologia della mobilità e nella generazione distribuita di energia, come nelle aree residenziali. Anche se l’uso delle celle a combustibile come principale fonte di energia richiede attualmente molti soldi, se si scoprissero catalizzatori più economici ed efficienti, membrane stabili con elevata conduttività e fonti alternative di idrogeno, le celle a combustibile a idrogeno potrebbero diventare molto interessanti dal punto di vista economico.
Una cella a combustibile è un dispositivo di conversione dell'energia elettrochimica che converte l'idrogeno e l'ossigeno in elettricità attraverso una reazione chimica. Come risultato di questo processo si forma acqua e viene rilasciata una grande quantità di calore. Una cella a combustibile è molto simile a una batteria che può essere caricata e quindi utilizzare l'energia elettrica immagazzinata.
William R. Grove è considerato l'inventore della cella a combustibile, che la inventò nel 1839. In questa cella a combustibile, una soluzione di acido solforico veniva utilizzata come elettrolita e come combustibile veniva utilizzato l'idrogeno, che veniva combinato con l'ossigeno in un agente ossidante. Va notato che fino a poco tempo fa le celle a combustibile venivano utilizzate solo nei laboratori e sui veicoli spaziali.
In futuro, le celle a combustibile saranno in grado di competere con molti altri sistemi di conversione dell’energia (comprese le turbine a gas nelle centrali elettriche), i motori a combustione interna nelle automobili e le batterie elettriche nei dispositivi portatili. I motori a combustione interna bruciano carburante e utilizzano la pressione creata dall'espansione dei gas di combustione per eseguire lavoro meccanico. Le batterie immagazzinano energia elettrica, quindi la convertono in energia chimica, che può essere riconvertita in energia elettrica, se necessario. Le celle a combustibile sono potenzialmente molto efficienti. Già nel 1824, lo scienziato francese Carnot dimostrò che i cicli di compressione-espansione di un motore a combustione interna non possono garantire un'efficienza di conversione dell'energia termica (che è l'energia chimica del combustibile che brucia) in energia meccanica superiore al 50%. Una cella a combustibile non ha parti in movimento (almeno non all'interno della cella stessa) e quindi non obbediscono alla legge di Carnot. Naturalmente avranno un’efficienza superiore al 50% e saranno particolarmente efficaci a carichi bassi. Pertanto, i veicoli a celle a combustibile sono destinati a diventare (e hanno già dimostrato di essere) più efficienti in termini di consumo di carburante rispetto ai veicoli convenzionali in condizioni di guida reali.
La cella a combustibile produce una corrente elettrica a tensione costante che può essere utilizzata per azionare il motore elettrico, l'illuminazione e altri sistemi elettrici del veicolo. Esistono diversi tipi di celle a combustibile, che differiscono per i processi chimici utilizzati. Le celle a combustibile sono generalmente classificate in base al tipo di elettrolita che utilizzano. Alcuni tipi di celle a combustibile sono promettenti per la propulsione delle centrali elettriche, mentre altri potrebbero essere utili per piccoli dispositivi portatili o per alimentare le automobili.
La cella a combustibile alcalina è una delle primissime celle sviluppate. Sono stati utilizzati nel programma spaziale statunitense dagli anni '60. Tali celle a combustibile sono molto suscettibili alla contaminazione e quindi richiedono idrogeno e ossigeno molto puri. Sono anche molto costose, il che significa che questo tipo di celle a combustibile probabilmente non vedrà un uso diffuso nelle automobili.
Le celle a combustibile basate sull'acido fosforico possono trovare applicazione in installazioni fisse a bassa potenza. Funzionano a temperature piuttosto elevate e quindi impiegano molto tempo per riscaldarsi, il che li rende inefficaci anche per l'uso in automobile.
Le celle a combustibile a ossido solido sono più adatte per grandi generatori di energia stazionari che potrebbero fornire energia a fabbriche o comunità. Questo tipo di cella a combustibile funziona a temperature molto elevate (intorno ai 1000 °C). L'elevata temperatura di esercizio crea alcuni problemi, ma d'altro canto c'è un vantaggio: il vapore prodotto dalla cella a combustibile può essere inviato alle turbine per generare più elettricità. Nel complesso, ciò migliora l’efficienza complessiva del sistema.
Uno dei sistemi più promettenti è la cella a combustibile con membrana a scambio protonico (PEMFC - Protone Exchange Membrane Fuel Cell). Attualmente questo tipo di celle a combustibile è il più promettente perché può alimentare automobili, autobus e altri veicoli.
Processi chimici in una cella a combustibile
Le celle a combustibile utilizzano un processo elettrochimico per combinare l'idrogeno con l'ossigeno ottenuto dall'aria. Come le batterie, le celle a combustibile utilizzano elettrodi (conduttori elettrici solidi) in un elettrolita (un mezzo elettricamente conduttivo). Quando le molecole di idrogeno entrano in contatto con l'elettrodo negativo (anodo), quest'ultimo si separa in protoni ed elettroni. I protoni passano attraverso una membrana a scambio protonico (POEM) fino all'elettrodo positivo (catodo) della cella a combustibile, producendo elettricità. Una combinazione chimica di molecole di idrogeno e ossigeno si verifica per formare acqua come sottoprodotto di questa reazione. L'unico tipo di emissioni provenienti da una cella a combustibile è il vapore acqueo.
L'elettricità prodotta dalle celle a combustibile può essere utilizzata nel gruppo propulsore elettrico di un veicolo (costituito da un convertitore di energia elettrica e un motore a induzione CA) per fornire energia meccanica per la propulsione del veicolo. Il compito di un convertitore di energia elettrica è convertire la corrente continua prodotta dalle celle a combustibile in corrente alternata che aziona il motore di trazione del veicolo.

Schema di una cella a combustibile con membrana a scambio protonico:
1 - anodo;
2 - membrana a scambio protonico (PEM);
3 - catalizzatore (rosso);
4 - catodo
La cella a combustibile con membrana a scambio protonico (PEMFC) utilizza una delle reazioni più semplici di qualsiasi cella a combustibile.

Cella a combustibile a cella singola
Diamo un'occhiata a come funziona una cella a combustibile. L'anodo, il terminale negativo della cella a combustibile, conduce gli elettroni che vengono liberati dalle molecole di idrogeno in modo che possano essere utilizzati nel circuito elettrico esterno. Per fare ciò, al suo interno vengono incisi dei canali che distribuiscono l'idrogeno in modo uniforme su tutta la superficie del catalizzatore. Il catodo (polo positivo della cella a combustibile) ha canali incisi che distribuiscono l'ossigeno sulla superficie del catalizzatore. Inoltre riconduce gli elettroni dal circuito esterno (circuito) al catalizzatore, dove possono combinarsi con ioni idrogeno e ossigeno per formare acqua. L'elettrolita è una membrana a scambio protonico. Si tratta di un materiale speciale simile alla plastica ordinaria, ma ha la capacità di consentire il passaggio di ioni caricati positivamente e di bloccare il passaggio degli elettroni.
Un catalizzatore è un materiale speciale che facilita la reazione tra ossigeno e idrogeno. Il catalizzatore è solitamente costituito da polvere di platino applicata in uno strato molto sottile su carta carbone o tessuto. Il catalizzatore deve essere ruvido e poroso in modo che la sua superficie possa entrare al massimo contatto con idrogeno e ossigeno. Il lato rivestito di platino del catalizzatore si trova davanti alla membrana a scambio protonico (PEM).
Il gas idrogeno (H2) viene fornito alla cella a combustibile sotto pressione dall'anodo. Quando una molecola di H2 entra in contatto con il platino sul catalizzatore, si divide in due parti, due ioni (H+) e due elettroni (e–). Gli elettroni vengono condotti attraverso l'anodo, dove passano attraverso un circuito esterno (circuito) svolgendo un lavoro utile (come azionare un motore elettrico) e ritornano sul lato catodico della cella a combustibile.
Nel frattempo, sul lato del catodo della cella a combustibile, il gas ossigeno (O 2 ) viene forzato attraverso il catalizzatore, dove forma due atomi di ossigeno. Ciascuno di questi atomi ha una forte carica negativa, che attrae due ioni H+ attraverso la membrana, dove si combinano con un atomo di ossigeno e due elettroni del circuito esterno per formare una molecola d'acqua (H 2 O).
Questa reazione in una singola cella a combustibile produce circa 0,7 W di potenza. Per aumentare la potenza al livello richiesto, molte singole celle a combustibile devono essere combinate per formare una pila di celle a combustibile.
Le celle a combustibile POM funzionano a temperature relativamente basse (circa 80°C), il che significa che possono essere rapidamente portate alla temperatura operativa e non richiedono costosi sistemi di raffreddamento. I continui miglioramenti nella tecnologia e nei materiali utilizzati in queste celle hanno portato la loro potenza più vicino al livello in cui una batteria di tali celle a combustibile, che occupa una piccola parte del bagagliaio di un'auto, può fornire l'energia necessaria per guidare l'auto.
Negli ultimi anni, la maggior parte dei principali produttori automobilistici del mondo ha investito massicciamente nello sviluppo di progetti di veicoli che utilizzano celle a combustibile. Molti hanno già dimostrato veicoli a celle a combustibile con caratteristiche di potenza e prestazioni soddisfacenti, sebbene fossero piuttosto costosi.
Il miglioramento del design di tali auto è molto intenso.

Il veicolo a celle a combustibile utilizza una centrale elettrica situata sotto il pavimento del veicolo
Il NECAR V è basato su un'auto Mercedes-Benz di classe A, con l'intero propulsore, insieme alle celle a combustibile, situato sotto il pavimento dell'auto. Questa soluzione progettuale consente di ospitare quattro passeggeri e bagagli nell'auto. Qui come carburante per l’auto non viene utilizzato l’idrogeno, ma il metanolo. Il metanolo, utilizzando un reformer (un dispositivo che converte il metanolo in idrogeno), viene convertito nell'idrogeno necessario per alimentare la cella a combustibile. L'utilizzo di un reformer a bordo di un'auto consente di utilizzare quasi tutti gli idrocarburi come carburante, il che consente di rifornire un'auto a celle a combustibile utilizzando la rete esistente di stazioni di servizio. In teoria, le celle a combustibile non producono altro che elettricità e acqua. La conversione del carburante (benzina o metanolo) nell’idrogeno necessario per una cella a combustibile riduce in qualche modo l’impatto ambientale di tale automobile.
Honda, che si occupa di celle a combustibile dal 1989, ha prodotto un piccolo lotto di automobili Honda FCX-V4 con celle a combustibile a scambio protonico nel 2003 tipo di membrana di Ballard. Queste celle a combustibile producono 78 kW energia elettrica, e per azionare le ruote motrici vengono utilizzati motori elettrici di trazione con una potenza di 60 kW e una coppia di 272 Nm. Un'auto a celle a combustibile, rispetto a un'auto tradizionale, ha una massa di circa il 40% in meno, che le fornisce dinamica eccellente e una riserva di idrogeno compresso consente un'autonomia fino a 355 km.

La Honda FCX utilizza l'energia elettrica generata dalle celle a combustibile per guidare.
La Honda FCX è il primo veicolo a celle a combustibile al mondo a ricevere la certificazione governativa negli Stati Uniti. L'auto è certificata secondo gli standard ZEV - Zero Emission Vehicle. La Honda non venderà ancora queste auto, ma ne affitterà circa 30 per unità. California e Tokyo, dove esistono già infrastrutture per il rifornimento di idrogeno.

Il concept car Hy Wire di General Motors ha un propulsore a celle a combustibile
General Motors sta conducendo ricerche approfondite sullo sviluppo e sulla creazione di veicoli a celle a combustibile.

Telaio per auto Hy Wire
La concept car GM Hy Wire ha ottenuto 26 brevetti. La base dell'auto è una piattaforma funzionale spessa 150 mm. All'interno della piattaforma sono presenti bombole di idrogeno, una centrale elettrica a celle a combustibile e sistemi di controllo del veicolo Tecnologie più recenti controllo elettronico via filo. Il telaio del veicolo Hy Wire è una piattaforma sottile che ospita tutti gli elementi principali della struttura del veicolo: serbatoi di idrogeno, celle a combustibile, batterie, motori elettrici e sistemi di controllo. Questo approccio alla progettazione rende possibile modificare la carrozzeria dell'auto durante il funzionamento. L'azienda sta inoltre testando prototipi di automobili a celle a combustibile Opel e progettando un impianto per la produzione di celle a combustibile.

Progettazione di un serbatoio per carburante a idrogeno liquefatto "sicuro".:
1 - dispositivo di riempimento;
2 - serbatoio esterno;
3 - supporti;
4 - sensore di livello;
5 - serbatoio interno;
6 - linea di riempimento;
7 - isolamento e vuoto;
8 - riscaldatore;
9 - scatola di montaggio
La BMW presta molta attenzione al problema dell'utilizzo dell'idrogeno come carburante per le automobili. Insieme a Magna Steyer, rinomata per il suo lavoro sull'uso dell'idrogeno liquefatto nell'esplorazione spaziale, BMW ha sviluppato un serbatoio per l'idrogeno liquefatto che può essere utilizzato nelle automobili.

I test hanno confermato la sicurezza dell'utilizzo di un serbatoio di idrogeno liquido
L'azienda ha condotto una serie di test per la sicurezza della struttura utilizzando metodi standard e ne ha confermato l'affidabilità.
Nel 2002, al salone dell'auto di Francoforte sul Meno (Germania), è stata presentata la Mini Cooper Hydrogen, che utilizza l'idrogeno liquefatto come carburante. Serbatoio di carburante Questa vettura occupa lo stesso spazio di un normale serbatoio di benzina. L'idrogeno in questa vettura non viene utilizzato per le celle a combustibile, ma come carburante per il motore a combustione interna.

La prima automobile di serie al mondo con una cella a combustibile al posto della batteria
Nel 2003 la BMW annunciò la produzione della prima vettura di serie dotata di cella a combustibile, la BMW 750 hL. Al posto della batteria tradizionale viene utilizzata una batteria a celle a combustibile. Questa vettura è dotata di un motore a combustione interna a 12 cilindri alimentato a idrogeno e la cella a combustibile funge da alternativa a una batteria convenzionale, consentendo al condizionatore d'aria e ad altri dispositivi elettrici di funzionare quando l'auto rimane parcheggiata per lunghi periodi senza il motore acceso.

Il riempimento dell'idrogeno viene effettuato da un robot, il conducente non è coinvolto in questo processo
La stessa azienda BMW ha sviluppato anche distributori robotizzati di rifornimento che garantiscono il rifornimento rapido e sicuro delle auto con idrogeno liquefatto.
L’emergere negli ultimi anni di un gran numero di sviluppi volti a creare automobili che utilizzino carburanti e propulsori alternativi suggerisce che i motori a combustione interna, che hanno dominato le automobili nel secolo scorso, alla fine lasceranno il posto a progetti più puliti, più efficienti e silenziosi. La loro adozione su vasta scala è attualmente limitata non da problemi tecnici, ma piuttosto da problemi economici e sociali. Per il loro utilizzo diffuso è necessario creare una certa infrastruttura per lo sviluppo della produzione di carburanti alternativi, la creazione e la distribuzione di nuove stazioni di servizio e superare una serie di barriere psicologiche. L’uso dell’idrogeno come carburante per veicoli richiederà di affrontare i problemi di stoccaggio, consegna e distribuzione, con l’adozione di serie misure di sicurezza.
L’idrogeno è teoricamente disponibile in quantità illimitate, ma la sua produzione richiede molta energia. Inoltre, per convertire le auto all’uso dell’idrogeno, è necessario apportare due grandi modifiche al sistema di alimentazione: in primo luogo, passare dalla benzina al metanolo e poi, col tempo, all’idrogeno. Ci vorrà del tempo prima che questo problema venga risolto.
Descrizione:
Questo articolo esamina più in dettaglio la loro progettazione, classificazione, vantaggi e svantaggi, ambito di applicazione, efficacia, storia della creazione e moderne prospettive di utilizzo.
Utilizzo delle celle a combustibile per alimentare gli edifici
Parte 1
Questo articolo esamina più in dettaglio il principio di funzionamento delle celle a combustibile, la loro progettazione, classificazione, vantaggi e svantaggi, ambito di applicazione, efficienza, storia della creazione e moderne prospettive di utilizzo. Nella seconda parte dell'articolo, che sarà pubblicato nel prossimo numero della rivista ABOK, fornisce esempi di impianti in cui sono stati utilizzati vari tipi di celle a combustibile come fonti di calore ed energia elettrica (o solo energia elettrica).
introduzione
Le celle a combustibile sono un modo molto efficiente, affidabile, durevole ed ecologico per generare energia.
Inizialmente utilizzate solo nell'industria spaziale, le celle a combustibile sono ora sempre più utilizzate in una varietà di settori: come centrali elettriche fisse, fornitura di calore ed elettricità per edifici, motori di veicoli, alimentatori per laptop e telefoni cellulari. Alcuni di questi dispositivi sono prototipi di laboratorio, altri sono sottoposti a test di pre-produzione o utilizzati a scopo dimostrativo, ma molti modelli sono prodotti in serie e utilizzati in progetti commerciali.
Una cella a combustibile (generatore elettrochimico) è un dispositivo che converte direttamente l'energia chimica del carburante (idrogeno) in energia elettrica attraverso una reazione elettrochimica, in contrasto con le tecnologie tradizionali che utilizzano la combustione di combustibili solidi, liquidi e gassosi. La conversione elettrochimica diretta del carburante è molto efficace e interessante dal punto di vista ambientale, poiché il processo operativo produce una quantità minima di sostanze inquinanti e non vi sono forti rumori o vibrazioni.
Da un punto di vista pratico, una cella a combustibile assomiglia ad una batteria voltaica convenzionale. La differenza è che la batteria inizialmente è carica, cioè piena di “carburante”. Durante il funzionamento si consuma “carburante” e la batteria si scarica. A differenza di una batteria, una cella a combustibile utilizza il carburante fornito da una fonte esterna per produrre energia elettrica (Fig. 1).
Per produrre energia elettrica si può utilizzare non solo l'idrogeno puro, ma anche altre materie prime contenenti idrogeno, come ad esempio gas naturale, ammoniaca, metanolo o benzina. L'aria ordinaria viene utilizzata come fonte di ossigeno, anch'essa necessaria per la reazione.
Quando si utilizza l'idrogeno puro come combustibile, i prodotti della reazione, oltre all'energia elettrica, sono calore e acqua (o vapore acqueo), cioè i gas che provocano l'inquinamento atmosferico o l'effetto serra non vengono emessi nell'atmosfera. Se come combustibile viene utilizzata una materia prima contenente idrogeno, come il gas naturale, altri gas come gli ossidi di carbonio e di azoto saranno un sottoprodotto della reazione, ma la quantità è molto inferiore rispetto a quando si brucia la stessa quantità di gas naturale. gas.
Il processo di conversione chimica del combustibile per produrre idrogeno è chiamato reforming e il dispositivo corrispondente è chiamato reformer.
Vantaggi e svantaggi delle celle a combustibile
Le celle a combustibile sono più efficienti dal punto di vista energetico rispetto ai motori a combustione interna perché non vi è alcuna limitazione di efficienza energetica termodinamica per le celle a combustibile. L'efficienza delle celle a combustibile è del 50%, mentre l'efficienza dei motori a combustione interna è del 12-15% e l'efficienza delle centrali elettriche a turbina a vapore non supera il 40%. Utilizzando calore e acqua, l’efficienza delle celle a combustibile viene ulteriormente aumentata.
A differenza, ad esempio, dei motori a combustione interna, l’efficienza delle celle a combustibile rimane molto elevata anche quando non funzionano a piena potenza. Inoltre, la potenza delle celle a combustibile può essere aumentata semplicemente aggiungendo singole unità, mentre l’efficienza non cambia, cioè gli impianti grandi sono altrettanto efficienti di quelli piccoli. Queste circostanze consentono di selezionare in modo molto flessibile la composizione dell'attrezzatura in base ai desideri del cliente e, in definitiva, portano ad una riduzione dei costi dell'attrezzatura.
Un vantaggio importante delle celle a combustibile è la loro compatibilità ambientale. Le emissioni delle celle a combustibile sono così basse che in alcune aree degli Stati Uniti il loro funzionamento non richiede un’approvazione speciale da parte dei regolatori governativi della qualità dell’aria.
Le celle a combustibile possono essere collocate direttamente in un edificio, riducendo le perdite durante il trasporto di energia, e il calore generato come risultato della reazione può essere utilizzato per fornire calore o acqua calda all'edificio. Le fonti autonome di calore ed elettricità possono essere molto utili nelle aree remote e nelle regioni caratterizzate da carenza di elettricità e dai suoi costi elevati, ma allo stesso tempo ci sono riserve di materie prime contenenti idrogeno (petrolio, gas naturale).
I vantaggi delle celle a combustibile sono anche la disponibilità di carburante, l'affidabilità (non ci sono parti mobili in una cella a combustibile), la durata e la facilità d'uso.
Uno dei principali svantaggi delle celle a combustibile oggi è il loro costo relativamente elevato, ma questo svantaggio può essere presto superato: sempre più aziende producono campioni commerciali di celle a combustibile, vengono costantemente migliorate e il loro costo diminuisce.
Il modo più efficace è utilizzare l’idrogeno puro come combustibile, ma ciò richiederà la creazione di un’infrastruttura speciale per la sua produzione e trasporto. Attualmente, tutti i progetti commerciali utilizzano gas naturale e combustibili simili. I veicoli a motore possono utilizzare benzina normale, il che consentirà di mantenere l'attuale rete sviluppata di stazioni di servizio. Tuttavia, l'utilizzo di tale combustibile comporta emissioni nocive nell'atmosfera (anche se molto basse) e complica (e quindi aumenta il costo) della cella a combustibile. In futuro, viene presa in considerazione la possibilità di utilizzare fonti di energia rinnovabile rispettose dell'ambiente (ad esempio energia solare o eolica) per decomporre l'acqua in idrogeno e ossigeno mediante elettrolisi e quindi convertire il combustibile risultante in una cella a combustibile. Tali impianti combinati, funzionanti a ciclo chiuso, possono rappresentare una fonte di energia completamente ecologica, affidabile, durevole ed efficiente.
Un'altra caratteristica delle celle a combustibile è che sono più efficienti quando utilizzano contemporaneamente sia l'energia elettrica che quella termica. Tuttavia, non tutte le strutture hanno la possibilità di utilizzare l’energia termica. Se le celle a combustibile vengono utilizzate solo per generare energia elettrica, la loro efficienza diminuisce, anche se supera quella degli impianti “tradizionali”.
Storia e uso moderno delle celle a combustibile
Il principio di funzionamento delle celle a combustibile fu scoperto nel 1839. Lo scienziato inglese William Robert Grove (1811-1896) scoprì che il processo di elettrolisi - la decomposizione dell'acqua in idrogeno e ossigeno attraverso la corrente elettrica - è reversibile, cioè l'idrogeno e l'ossigeno possono essere combinati in molecole d'acqua senza combustione, ma con il rilascio di calore e corrente elettrica. Grove chiamò il dispositivo in cui tale reazione era possibile una “batteria a gas”, che fu la prima cella a combustibile.
Lo sviluppo attivo delle tecnologie per l'utilizzo delle celle a combustibile è iniziato dopo la seconda guerra mondiale ed è associato all'industria aerospaziale. A quel tempo era in corso la ricerca di una fonte di energia efficace e affidabile, ma allo stesso tempo abbastanza compatta. Negli anni '60, gli specialisti della NASA (National Aeronautics and Space Administration, NASA) scelsero le celle a combustibile come fonte di energia per le navicelle spaziali dei programmi Apollo (voli con equipaggio sulla Luna), Apollo-Soyuz, Gemini e Skylab. La navicella spaziale Apollo utilizzava tre impianti da 1,5 kW (2,2 kW di picco) che utilizzavano idrogeno e ossigeno criogenici per produrre elettricità, calore e acqua. La massa di ciascuna installazione era di 113 kg. Queste tre celle funzionavano in parallelo, ma l'energia generata da una unità era sufficiente per un ritorno sicuro. Nel corso di 18 voli le celle a combustibile hanno funzionato per un totale di 10.000 ore senza alcun guasto. Attualmente le celle a combustibile vengono utilizzate nello Space Shuttle, che utilizza tre unità da 12 W per generare tutta l'energia elettrica a bordo del veicolo spaziale (Fig. 2). L'acqua ottenuta dalla reazione elettrochimica viene utilizzata per l'acqua potabile e anche per le apparecchiature di raffreddamento.
Nel nostro Paese si è lavorato anche per la realizzazione di celle a combustibile da utilizzare in astronautica. Ad esempio, le celle a combustibile furono utilizzate per alimentare la navicella spaziale riutilizzabile sovietica Buran.
Lo sviluppo di metodi per l'uso commerciale delle celle a combustibile iniziò a metà degli anni '60. Questi sviluppi sono stati parzialmente finanziati da organizzazioni governative.
Attualmente lo sviluppo delle tecnologie per l'utilizzo delle celle a combustibile procede in più direzioni. Si tratta della creazione di centrali elettriche stazionarie a celle a combustibile (sia per l'approvvigionamento energetico centralizzato che decentralizzato), centrali elettriche per veicoli (sono stati creati campioni di automobili e autobus a celle a combustibile, anche nel nostro paese) (Fig. 3), e anche alimentatori per vari dispositivi mobili (computer portatili, telefoni cellulari, ecc.) (Fig. 4).
Esempi dell'uso delle celle a combustibile in vari campi sono riportati nella Tabella. 1.
Uno dei primi modelli commerciali di celle a combustibile progettati per la fornitura autonoma di calore ed energia agli edifici è stato il PC25 Modello A prodotto da ONSI Corporation (ora United Technologies, Inc.). Questa cella a combustibile con una potenza nominale di 200 kW è un tipo di cella con un elettrolita a base di acido fosforico (Phosphoric Acid Fuel Cells, PAFC). Il numero "25" nel nome del modello indica il numero di serie del modello. La maggior parte dei modelli precedenti erano unità sperimentali o di prova, come il modello "PC11" da 12,5 kW introdotto negli anni '70. I nuovi modelli hanno aumentato la potenza estratta da una singola cella a combustibile e hanno anche ridotto il costo per kilowatt di energia prodotta. Attualmente, uno dei modelli commerciali più efficienti è la cella a combustibile PC25 Modello C. Come il modello A, questa è una cella a combustibile PAFC da 200 kW completamente automatica progettata per l'installazione in loco come fonte autonoma di calore ed energia. Una tale cella a combustibile può essere installata all'esterno di un edificio. Esternamente è un parallelepipedo lungo 5,5 m, largo 3 m ed alto, del peso di 18.140 kg. La differenza rispetto ai modelli precedenti è un riformatore migliorato e una densità di corrente più elevata.
| Tabella 1 Campo di applicazione delle celle a combustibile |
|||||||||||||||
|
In alcuni tipi di celle a combustibile, il processo chimico può essere invertito: applicando una differenza di potenziale agli elettrodi, l’acqua può essere scomposta in idrogeno e ossigeno, che si raccolgono sugli elettrodi porosi. Quando viene collegato un carico, tale cella a combustibile rigenerativa inizierà a produrre energia elettrica.
Una direzione promettente per l'uso delle celle a combustibile è il loro utilizzo insieme a fonti di energia rinnovabile, ad esempio pannelli fotovoltaici o impianti eolici. Questa tecnologia ci consente di evitare completamente l’inquinamento atmosferico. Si prevede di creare un sistema simile, ad esempio, presso il Centro di formazione Adam Joseph Lewis di Oberlin (vedi ABOK, 2002, n. 5, p. 10). Attualmente, i pannelli solari sono utilizzati come una delle fonti energetiche in questo edificio. Insieme agli specialisti della NASA è stato sviluppato un progetto per l'utilizzo di pannelli fotovoltaici per produrre idrogeno e ossigeno dall'acqua mediante elettrolisi. L'idrogeno viene poi utilizzato nelle celle a combustibile per produrre energia elettrica e acqua calda. Ciò consentirà all'edificio di mantenere la funzionalità di tutti i sistemi durante le giornate nuvolose e di notte.
Principio di funzionamento delle celle a combustibile
Consideriamo il principio di funzionamento di una cella a combustibile utilizzando l'esempio di un semplice elemento con una membrana a scambio protonico (Proton Exchange Membrane, PEM). Tale cella è costituita da una membrana polimerica posta tra un anodo (elettrodo positivo) e un catodo (elettrodo negativo) insieme a catalizzatori anodici e catodici. La membrana polimerica viene utilizzata come elettrolita. Lo schema dell'elemento PEM è mostrato in Fig. 5.
Una membrana a scambio protonico (PEM) è un composto organico solido sottile (circa 2-7 fogli di carta spessi). Questa membrana funziona come un elettrolita: separa una sostanza in ioni caricati positivamente e negativamente in presenza di acqua.
All'anodo avviene un processo di ossidazione e al catodo avviene un processo di riduzione. L'anodo e il catodo in una cella PEM sono costituiti da un materiale poroso, ovvero una miscela di particelle di carbonio e platino. Il platino agisce come un catalizzatore che promuove la reazione di dissociazione. L'anodo e il catodo sono resi porosi per il libero passaggio rispettivamente dell'idrogeno e dell'ossigeno attraverso di essi.
L'anodo e il catodo sono posti tra due piastre metalliche, che forniscono idrogeno e ossigeno all'anodo e al catodo e rimuovono calore e acqua, nonché energia elettrica.
Le molecole di idrogeno passano attraverso i canali della piastra fino all'anodo, dove vengono decomposte in singoli atomi (Fig. 6).
Figura 5. () Schema di una cella a combustibile con membrana a scambio protonico (cella PEM) |
|
Figura 6. () Le molecole di idrogeno passano attraverso i canali della piastra fino all'anodo, dove le molecole si decompongono in singoli atomi |
|
Figura 7. () Come risultato del chemisorbimento in presenza di un catalizzatore, gli atomi di idrogeno vengono convertiti in protoni |
|
Figura 8. () Gli ioni idrogeno caricati positivamente si diffondono attraverso la membrana verso il catodo e un flusso di elettroni viene diretto al catodo attraverso un circuito elettrico esterno a cui è collegato il carico |
|
Figura 9. () L'ossigeno fornito al catodo, in presenza di un catalizzatore, entra in una reazione chimica con gli ioni idrogeno dalla membrana a scambio protonico e gli elettroni dal circuito elettrico esterno. Come risultato di una reazione chimica, si forma acqua |
Quindi, come risultato del chemisorbimento in presenza di un catalizzatore, gli atomi di idrogeno, ciascuno dei quali cede un elettrone e –, vengono convertiti in ioni idrogeno H + con carica positiva, cioè protoni (Fig. 7).
Gli ioni idrogeno (protoni) caricati positivamente si diffondono attraverso la membrana fino al catodo e il flusso di elettroni viene diretto al catodo attraverso un circuito elettrico esterno a cui è collegato il carico (consumatore di energia elettrica) (Fig. 8).
L'ossigeno fornito al catodo, in presenza di un catalizzatore, entra in una reazione chimica con gli ioni idrogeno (protoni) dalla membrana a scambio protonico e gli elettroni dal circuito elettrico esterno (Fig. 9). Come risultato di una reazione chimica, si forma acqua.
La reazione chimica in altri tipi di celle a combustibile (ad esempio con un elettrolita acido, che utilizza una soluzione di acido ortofosforico H 3 PO 4) è assolutamente identica alla reazione chimica in una cella a combustibile con membrana a scambio protonico.
In qualsiasi cella a combustibile, parte dell'energia derivante da una reazione chimica viene rilasciata sotto forma di calore.
Il flusso di elettroni in un circuito esterno è una corrente continua utilizzata per svolgere lavoro. L'apertura del circuito esterno o l'arresto del movimento degli ioni idrogeno arresta la reazione chimica.
La quantità di energia elettrica prodotta da una cella a combustibile dipende dal tipo di cella a combustibile, dalle dimensioni geometriche, dalla temperatura, dalla pressione del gas. Una cella a combustibile separata fornisce una forza elettromagnetica inferiore a 1,16 V. La dimensione delle celle a combustibile può essere aumentata, ma in pratica vengono utilizzati diversi elementi collegati alle batterie (Fig. 10).
Progettazione di celle a combustibile
Diamo un'occhiata al progetto di una cella a combustibile utilizzando come esempio il PC25 Modello C. Lo schema della cella a combustibile è mostrato in Fig. undici.
La cella a combustibile PC25 Modello C è composta da tre parti principali: il processore del combustibile, la sezione di generazione di energia vera e propria e il convertitore di tensione.
La parte principale della cella a combustibile, ovvero la sezione di generazione dell'energia, è una batteria composta da 256 singole celle a combustibile. Gli elettrodi della cella a combustibile contengono un catalizzatore al platino. Queste celle producono una corrente elettrica costante di 1.400 ampere a 155 volt. Le dimensioni della batteria sono circa 2,9 m di lunghezza e 0,9 m di larghezza e altezza.
Poiché il processo elettrochimico avviene ad una temperatura di 177 °C, è necessario riscaldare la batteria al momento dell'avvio e sottrarla al calore durante il funzionamento. Per raggiungere questo obiettivo, la cella a combustibile comprende un circuito dell'acqua separato e la batteria è dotata di speciali piastre di raffreddamento.
Il processore di carburante converte il gas naturale nell'idrogeno necessario per una reazione elettrochimica. Questo processo è chiamato riforma. L'elemento principale del processore di carburante è il riformatore. Nel reformer, il gas naturale (o altro combustibile contenente idrogeno) reagisce con il vapore acqueo ad alta temperatura (900 °C) e ad alta pressione in presenza di un catalizzatore di nichel. In questo caso si verificano le seguenti reazioni chimiche:
CH4 (metano) + H2O3H2 + CO
(la reazione è endotermica, con assorbimento di calore);
CO + H2OH2 + CO2
(la reazione è esotermica, liberando calore).
La reazione complessiva è espressa dall’equazione:
CH 4 (metano) + 2H 2 O 4H 2 + CO 2
(la reazione è endotermica, con assorbimento di calore).
Per fornire l'elevata temperatura richiesta per convertire il gas naturale, una parte del combustibile esaurito proveniente dallo stack di celle a combustibile viene diretta a un bruciatore, che mantiene la temperatura del reformer richiesta.
Il vapore necessario per il reforming viene generato dalla condensa generata durante il funzionamento della cella a combustibile. Questo utilizza il calore rimosso dalla batteria di celle a combustibile (Fig. 12).
Lo stack di celle a combustibile produce una corrente continua intermittente a bassa tensione e alta corrente. Un convertitore di tensione viene utilizzato per convertirlo in corrente CA standard industriale. Inoltre, l'unità convertitore di tensione comprende vari dispositivi di controllo e circuiti di interblocco di sicurezza che consentono lo spegnimento della cella a combustibile in caso di vari guasti.
In una cella a combustibile di questo tipo circa il 40% dell'energia del combustibile può essere convertita in energia elettrica. Circa la stessa quantità, circa il 40% dell'energia del combustibile, può essere convertita in energia, che viene poi utilizzata come fonte di calore per il riscaldamento, la fornitura di acqua calda e scopi simili. Pertanto, l'efficienza totale di tale installazione può raggiungere l'80%.
Un vantaggio importante di tale fonte di fornitura di calore ed elettricità è la sua possibilità funzionamento automatico. Per la manutenzione, i proprietari dell'impianto in cui è installata la cella a combustibile non hanno bisogno di mantenere personale appositamente formato: la manutenzione periodica può essere effettuata dai dipendenti dell'organizzazione operativa.
Tipi di celle a combustibile
Attualmente sono noti diversi tipi di celle a combustibile che differiscono per la composizione dell'elettrolita utilizzato. I seguenti quattro tipi sono i più diffusi (Tabella 2):
1. Celle a combustibile con membrana a scambio protonico (Proton Exchange Membrane Fuel Cells, PEMFC).
2. Celle a combustibile a base di acido ortofosforico (Phosphoric Acid Fuel Cells, PAFC).
3. Celle a combustibile a carbonato fuso (Molten Carbonate Fuel Cells, MCFC).
4. Celle a combustibile a ossido solido (SOFC). Attualmente, la più grande flotta di celle a combustibile si basa sulla tecnologia PAFC.
Una delle caratteristiche chiave dei diversi tipi di celle a combustibile è la temperatura operativa. In molti modi è la temperatura a determinare il campo di applicazione delle celle a combustibile. Ad esempio, le alte temperature sono fondamentali per i laptop, quindi per questo segmento di mercato vengono sviluppate celle a combustibile con membrana a scambio protonico con basse temperature operative.
Per l'alimentazione autonoma degli edifici sono necessarie celle a combustibile con elevata potenza installata e allo stesso tempo esiste la possibilità di utilizzare energia termica, quindi per questi scopi possono essere utilizzati altri tipi di celle a combustibile.
Celle a combustibile con membrana a scambio protonico (PEMFC)
Queste celle a combustibile funzionano a temperature operative relativamente basse (60-160 °C). Hanno un'elevata densità di potenza, consentono di regolare rapidamente la potenza di uscita e possono essere accesi rapidamente. Lo svantaggio di questo tipo di elementi sono gli elevati requisiti di qualità del carburante, poiché il carburante contaminato può danneggiare la membrana. La potenza nominale di questo tipo di celle a combustibile è 1-100 kW.
Le celle a combustibile con membrana a scambio protonico furono originariamente sviluppate dalla General Electric negli anni '60 per la NASA. Questo tipo di cella a combustibile utilizza un elettrolita polimerico allo stato solido chiamato membrana a scambio protonico (PEM). I protoni possono muoversi attraverso la membrana a scambio protonico, ma gli elettroni non possono attraversarla, determinando una differenza di potenziale tra catodo e anodo. A causa della loro semplicità e affidabilità, tali celle a combustibile sono state utilizzate come fonte di energia sulla navicella spaziale Gemini con equipaggio.
Questo tipo di cella a combustibile viene utilizzata come fonte di energia per un'ampia gamma di dispositivi diversi, inclusi prototipi e prototipi, dai telefoni cellulari agli autobus e ai sistemi di alimentazione fissi. La bassa temperatura operativa consente di utilizzare tali celle per alimentare vari tipi di dispositivi elettronici complessi. Il loro utilizzo è meno efficace come fonte di fornitura di calore ed elettricità agli edifici pubblici e industriali, dove sono richiesti grandi volumi di energia termica. Allo stesso tempo, tali elementi sono promettenti come fonte autonoma di alimentazione elettrica per piccoli edifici residenziali, come i cottage costruiti in regioni con clima caldo.
| Tavolo 2 Tipi di celle a combustibile |
||||||||||||||||||||
|
Celle a combustibile ad acido fosforico (PAFC)
Test di celle a combustibile di questo tipo furono effettuati già all'inizio degli anni '70. Intervallo di temperatura operativa: 150-200 °C. L'area di applicazione principale sono le fonti autonome di calore ed elettricità di media potenza (circa 200 kW).
Queste celle a combustibile utilizzano una soluzione di acido fosforico come elettrolita. Gli elettrodi sono costituiti da carta rivestita di carbone in cui è disperso un catalizzatore di platino.
L'efficienza elettrica delle celle a combustibile PAFC è del 37-42%. Tuttavia, poiché queste celle a combustibile funzionano a temperature piuttosto elevate, è possibile utilizzare il vapore generato durante il funzionamento. In questo caso l’efficienza complessiva può raggiungere l’80%.
Per produrre energia, le materie prime contenenti idrogeno devono essere convertite in idrogeno puro attraverso un processo di reforming. Ad esempio, se come combustibile si utilizza benzina, è necessario rimuovere i composti contenenti zolfo, poiché lo zolfo può danneggiare il catalizzatore al platino.
Le celle a combustibile PAFC sono state le prime celle a combustibile commerciali ad essere utilizzate in modo economico. Il modello più comune era la cella a combustibile PC25 da 200 kW prodotta da ONSI Corporation (ora United Technologies, Inc.) (Fig. 13). Questi elementi vengono utilizzati, ad esempio, come fonte di energia termica ed elettrica nella stazione di polizia di Central Park a New York o come ulteriore fonte di energia nel Conde Nast Building e Four Times Square. Più installazione di grandi dimensioni Questo tipo è in fase di test come centrale elettrica da 11 MW situata in Giappone.
Le celle a combustibile ad acido fosforico vengono utilizzate anche come fonte di energia nei veicoli. Ad esempio, nel 1994, H-Power Corp., Georgetown University e il Dipartimento dell'Energia degli Stati Uniti hanno dotato un autobus di una centrale elettrica da 50 kW.
Celle a combustibile a carbonati fusi (MCFC)
Le celle a combustibile di questo tipo funzionano a temperature molto elevate - 600-700 °C. Queste temperature di esercizio consentono l'utilizzo del combustibile direttamente nella cella stessa, senza l'utilizzo di un reformer separato. Questo processo è stato chiamato “riforma interna”. Permette di semplificare notevolmente la progettazione della cella a combustibile.
Le celle a combustibile basate sul carbonato fuso richiedono un tempo di avvio significativo e non consentono una rapida regolazione della potenza di uscita, quindi il loro campo di applicazione principale sono le grandi fonti stazionarie di energia termica ed elettrica. Tuttavia, sono caratterizzati da un'elevata efficienza di conversione del carburante: efficienza elettrica del 60% e efficienza complessiva fino all'85%.
In questo tipo di cella a combustibile l'elettrolita è costituito da sali di carbonato di potassio e carbonato di litio riscaldati a circa 650 °C. In queste condizioni, i sali sono allo stato fuso, formando un elettrolita. All'anodo l'idrogeno reagisce con gli ioni CO 3, formando acqua, anidride carbonica e rilasciando elettroni, che vengono inviati al circuito esterno, mentre al catodo l'ossigeno interagisce con l'anidride carbonica e gli elettroni del circuito esterno, formando nuovamente ioni CO 3 .
Campioni di laboratorio di celle a combustibile di questo tipo furono creati alla fine degli anni '50 dagli scienziati olandesi G. H. J. Broers e J. A. A. Ketelaar. Negli anni '60, l'ingegnere Francis T. Bacon, discendente del famoso scrittore e scienziato inglese del XVII secolo, lavorò con queste celle, motivo per cui le celle a combustibile MCFC sono talvolta chiamate celle Bacon. Nei programmi Apollo, Apollo-Soyuz e Scylab della NASA, queste celle a combustibile sono state utilizzate come fonte di approvvigionamento energetico (Fig. 14). Durante questi stessi anni, il dipartimento militare statunitense testò diversi campioni di celle a combustibile MCFC prodotte da Texas Instruments, che utilizzavano benzina di tipo militare come combustibile. A metà degli anni ’70, il Dipartimento dell’Energia degli Stati Uniti iniziò la ricerca per creare una cella a combustibile stazionaria basata su carbonato fuso, adatta per applicazione pratica. Negli anni '90 furono introdotti numerosi impianti commerciali con una potenza nominale fino a 250 kW, ad esempio presso la base aerea navale statunitense di Miramar in California. Nel 1996, FuelCell Energy, Inc. ha lanciato un impianto di pre-produzione da 2 MW a Santa Clara, in California.
Celle a combustibile a ossidi allo stato solido (SOFC)
Le celle a combustibile a ossidi allo stato solido sono semplici nel design e funzionano a temperature molto elevate: 700-1.000 °C. Temperature così elevate consentono l’uso di carburante relativamente “sporco” e non raffinato. Le stesse caratteristiche delle celle a combustibile a base di carbonato fuso determinano un campo di applicazione simile: grandi fonti stazionarie di energia termica ed elettrica.
Le celle a combustibile a ossidi solidi sono strutturalmente diverse dalle celle a combustibile basate sulle tecnologie PAFC e MCFC. L'anodo, il catodo e l'elettrolita sono realizzati con gradi speciali di ceramica. L'elettrolita più comunemente utilizzato è una miscela di ossido di zirconio e ossido di calcio, ma possono essere utilizzati anche altri ossidi. L'elettrolita forma un reticolo cristallino rivestito su entrambi i lati con materiale elettrodico poroso. Strutturalmente, tali elementi sono realizzati sotto forma di tubi o pannelli piatti, il che consente di utilizzare nella loro produzione tecnologie ampiamente utilizzate nell'industria elettronica. Di conseguenza, le celle a combustibile a ossidi allo stato solido possono funzionare a temperature molto elevate, il che le rende vantaggiose per la produzione di energia elettrica e termica.
A temperature operative elevate, al catodo si formano ioni di ossigeno, che migrano attraverso il reticolo cristallino fino all'anodo, dove interagiscono con gli ioni idrogeno, formando acqua e rilasciando elettroni liberi. In questo caso l’idrogeno viene separato dal gas naturale direttamente nella cella, ovvero non è necessario un reformer separato.
Le basi teoriche per la creazione di celle a combustibile a ossidi allo stato solido furono gettate alla fine degli anni '30, quando gli scienziati svizzeri Emil Bauer e H. Preis sperimentarono con zirconio, ittrio, cerio, lantanio e tungsteno, utilizzandoli come elettroliti.
I primi prototipi di tali celle a combustibile furono creati alla fine degli anni '50 da diverse aziende americane e olandesi. La maggior parte di queste aziende abbandonò presto ulteriori ricerche a causa di difficoltà tecnologiche, ma una di loro, la Westinghouse Electric Corp. (ora Siemens Westinghouse Power Corporation), ha continuato a lavorare. L'azienda sta attualmente accettando preordini per un modello commerciale di cella a combustibile tubolare a ossido di stato solido, la cui disponibilità è prevista quest'anno (Figura 15). Il segmento di mercato di tali elementi è impianti fissi per la produzione di energia termica ed elettrica con potenza da 250 kW a 5 MW.
Le celle a combustibile SOFC hanno dimostrato un'affidabilità molto elevata. Ad esempio, un prototipo di cella a combustibile prodotto da Siemens Westinghouse ha raggiunto 16.600 ore di funzionamento e continua a funzionare, il che la rende la cella a combustibile con la vita continua più lunga al mondo.
La modalità operativa ad alta temperatura e alta pressione delle celle a combustibile SOFC consente la creazione di impianti ibridi in cui le emissioni delle celle a combustibile azionano le turbine a gas utilizzate per generare energia elettrica. La prima installazione ibrida di questo tipo è operativa a Irvine, in California. La potenza nominale di questo impianto è di 220 kW, di cui 200 kW dalla cella a combustibile e 20 kW dal generatore a microturbina.




