Что такое алканы: строение и химические свойства. Алканы – определение, строение, физические и химические свойства
Определение 1
Алканами называют такие углеводороды, атомы углерода, в молекулах которых соединены между собой простыми (одинарными) $\sigma $- связями. Все остальные единицы валентности атомов углерода в этих соединениях заняты (насыщенны) атомами водорода.
Атомы углерода в молекулах насыщенных углеводородов находятся в первом валентном состоянии, то есть в состоянии $sp3$-гибридизации. Такие насыщенные углеводороды еще называют парафинами .
Парафинами эти органические соединения называют потому, что долгое время их считали малореакцийноспособными (от лат. parum - мало и affinis - имеет сродство).
Старое название насыщенных углеводородов - алифатические или жирные, углеводороды (от лат. alifatic - жирный). Это название происходит от названия первых изученных соединений, которые когда-то относили к этим веществам, - жиров.
Насыщенные углеводороды образуют ряд соединений с общей формулой $C_nH_{(2_n+2)}$ $(n - 1, 2, 3, 4, ...)$. Простой соединением этого ряда является метан $CH_4$. Поэтому ряд этих соединений называют еще рядом метановых углеводородов.
Гомологические ряды
Соединения ряда метана имеют подобные строение и свойства. Такой ряд соединений, представители которого имеют близкие химические свойства и характеризуются закономерной сменой физических свойств, имеют однотипную структуру и отличаются друг от друга на одну или несколько $-CH_2$-групп, называют гомологичным рядом (от греч. «гомос » - сходство). Каждый последующий углеводород данного ряда отличается от предыдущего на группу $-CH_2$. Эта группа называется гомологичной разницей, а отдельные члены этого ряда - гомологами.
Происхождение названий алканов
Названия первых четырех насыщенных углеводородов (метан, этан, пропан, бутан) возникли случайно. Например, корень слова «этан» произошел от латинского слова ether - эфиы, так как остаток этана $-C_2H_5$ входит в состав медицинского эфира. Начиная с $C_5H_{12}$, названия алканов образованы от греческих или латинских числительных, которые указывают количество углеродных атомов в молекуле данного насыщенного углеводорода с добавлением к этим названиям суффикса -ан. Так, углеводород $C_5H_{12}$ называется пентан (от греч. «пента » - пять), $C_6H_{14}$ - гексан (от греч. «гекса » - шесть), $C_7H_{10}$ - гептан (от греч. «гепта » - семь) и т. д.
Правила систематической номенклатуры
Для названия органических веществ комиссией Международного союза теоретической и прикладной химии (IUPAC) были разработаны правила систематической (научной) номенклатуры. Согласно этим правилам, названия углеводородам дают таким образом:
В молекуле углеводорода выбирают основную - длинную и сложную (которая имеет наибольшее число ответвлений) - углеродную цепь.
Нумеруют атомы углерода основной цепи. Нумерацию осуществляют последовательно с того конца цепи, который дает радикалу наименьший номер. Если существует несколько алкильных радикалов, то сравнивают величину цифр двух возможных последовательных нумерации. И нумерация, в которой первой встречается меньше цифра, чем во второй последовательной нумерации, считается «меньше» и используется для составления названия углеводорода.
Нумерация справа налево будет «меньше», чем нумерация слева направо.
Называют углеводородные радикалы, которые образуют боковые цепи. Перед названием каждого радикала ставят цифру, которая указывает номер углеродного атома главной цепи, у которого с находится данный радикал. Цифру от названия отделяют дефисом. Названия алкильных радикалов перечисляют в алфавитном порядке. Если углеводород имеет в своем составе несколько одинаковых радикалов, то записывают в порядке возрастания номера углеродных атомов, у которых стоят эти радикалы. Цифры отделяют друг от друга запятыми. После цифр записывают префиксы: ди- (если одинаковых радикалов два), три- (когда одинаковых радикалов три), тетра-, пента- и т. д. (если одинаковых радикалов соответственно четыре, пять и т. д.). Префиксы указывают, сколько одинаковых радикалов имеет данный углеводород. После префикса ставят название радикала. В том случае, если два одинаковых радикалы находятся у одного углеродного атома, номер этого атома углерода ставится в названии дважды.
Называют углеводород основной пронумерованной углеродной цепи, помня при этом, что названия всех насыщенных углеводородов имеют суффикс -ан.
Приведенный ниже пример поможет уяснить эти правила:
Рисунок 1.
Алкильные радикалы боковых цепей
Иногда алкильные радикалы боковых цепей разветвленные. В этом случае их называют так, как соответствующие насыщенные углеводороды, только вместо суффикса -ан принимают суффикс -ил.
Углеродную цепь разветвленного радикала нумеруют. Атом углерода этого радикала, соединенный с основным цепью, получает номер $1$. Для удобства углеродную цепь разветвленного радикала нумеруют цифрами со штрихами и полное название такого радикала берут в скобки:
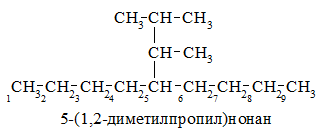
Рисунок 2.
Рациональная номенклатура
Кроме систематической для названия насыщенных углеводородов используют еще рациональную номенклатуру. По этой номенклатуре насыщенные углеводороды рассматривают как производные метана, в молекуле которого один или несколько атомов водорода замещены на радикалы. Название насыщенного углеводорода по рациональной номенклатуре образуют таким образом: называют по степени сложности все радикалы, которые находятся у атома углерода с наибольшим количеством заместителей (отмечая их количество, если они одинаковые), а затем добавляют основу названия углеводорода по этой номенклатуре - слово «метан». К примеру:

Рисунок 3.
Рациональную номенклатуру пользуются для названия сравнительно простых углеводородов. Эта номенклатура не так усовершенствована и гораздо менее удобна в пользовании по сравнению с систематической номенклатурой. По рациональной номенклатуре одно и то же вещество может иметь разные названия, что очень неудобно. Кроме того, по данной номенклатуре можно назвать далеко не все насыщенные углеводороды.
Алканы - соединения гомологического ряда метана. Это насыщенные нециклические углеводороды. Химические свойства алканов зависят от строения молекулы и физического состояния веществ.
Строение алканов
Молекула алкана состоит из атомов углерода и водорода, которые образуют метиленовые (-CH 2 -) и метильные (-CH 3) группы. Углерод может создавать четыре ковалентные неполярные связи с соседними атомами. Именно наличие прочных σ-связей -С-С- и -С-Н обуславливает инертность гомологического ряда алканов.

Рис. 1. Строение молекулы алкана.
Соединения реагируют на свету или при нагревании. Реакции протекают по цепному (свободно-радикальному) механизму. Таким образом, связи способны расщепляться только под действием свободных радикалов. В результате замещения водорода образуются галогеналканы, соли, циклоалканы.
Алканы относятся к предельным или насыщенным углеродам. Это значит, что молекулы содержат максимальное количество атомов водорода. Из-за отсутствия свободных связей реакции присоединения для алканов не характерны.
Химические свойства
Общие свойства алканов приведены в таблице.
|
Типы химических реакций |
Описание |
Уравнение |
|
Галогенирование |
Реагируют с F 2 , Cl 2 , Br 2 . Реакция с йодом не идёт. Галогены замещают атом водорода. Реакция с фтором сопровождается взрывом. Хлорирование и бромирование происходит при температуре 300-400°C. В результате образуются галогеналканы |
CH 4 + Cl 2 → CH 3 Cl + HCl |
|
Нитрование (реакция Коновалова) |
Взаимодействие с разбавленной азотной кислотой при температуре 140°C. Атом водорода замещается нитрогруппой NO 2 . В результате образуются нитроалканы |
CH 3 -CH 3 +HNO 3 → CH 3 -CH 2 -NO 2 + H 2 O |
|
Сульфохлорирование |
Сопровождается окислением с образованием алкансульфонилхлоридов |
R-H + SO 2 + Cl 2 → R-SO 3 Cl + HCl |
|
Сульфоокисление |
Образование алкансульфоновых кислот в избытке кислорода. Атом водорода замещается группой SO 3 H |
C 5 H 10 + HOSO 3 H → C 5 H 11 SO 3 H + H 2 O |
|
Происходит в присутствии катализатора при высоких температурах. В результате разрыва связей С-С образуются алканы и алкены |
C 4 H 10 → C 2 H 6 + C 2 H 4 |
|
|
В избытке кислорода происходит полное окисление до углекислого газа. При недостатке кислорода происходит неполное окисление с образованием угарного газа, сажи |
CH 4 + 2O 2 → CO 2 + 2H 2 O; 2CH 4 + 3O 2 → 2CO + 4H 2 O |
|
|
Каталитическое окисление |
Происходит частичное окисление алканов при небольшой температуре и в присутствии катализаторов. Могут образовываться кетоны, альдегиды, спирты, карбоновые кислоты |
C 4 H 10 → 2CH 3 COOH + H 2 O |
|
Дегидрирование |
Отщепление водорода в результате разрыва связей С-Н в присутствии катализатора (платины, оксида алюминия, оксида хрома) при температуре 400-600°С. Образуются алкены |
C 2 H 6 → C 2 H 4 + H 2 |
|
Ароматизация |
Реакция дегидрирования с образованием циклоалканов |
C 6 H 14 → C 6 H 6 + 4H 2 |
|
Изомеризация |
Образование изомеров под действием температуры и катализаторов |
C 5 H 12 → CH 3 -CH(CH 3)-CH 2 -CH 3 |
Чтобы понимать, как проходит реакция и какие радикалы замещаются, рекомендуется записывать структурные формулы.

Рис. 2. Структурные формулы.
Применение
Алканы широко применяются в промышленной химии, косметологии, строительстве. Из соединений изготавливают:
- топливо (бензин, керосин);
- асфальт;
- смазочные масла;
- вазелин;
- парафин;
- мыло;
- лаки;
- краски;
- эмали;
- спирты;
- синтетические ткани;
- каучук;
- адьдегиды;
- пластмассы;
- моющие средства;
- кислоты;
- пропелленты;
- косметические средства.

Рис. 3. Продукция, получаемая из алканов.
Что мы узнали?
Узнали о химических свойствах и применении алканов. Из-за прочных ковалентных связей между атомами углерода, а также между атомами углерода и водорода, алканы проявляют инертность. Возможны реакции замещения и разложения в присутствии катализатора при высоких температурах. Алканы - предельные углеводороды, поэтому реакции присоединения невозможны. Алканы используются для производства материалов, моющих средств, органических соединений.
Тест по теме
Оценка доклада
Средняя оценка: 4.1 . Всего получено оценок: 227.
Предельные углеводороды - это такие соединения, которые представляют собой молекулы, состоящие из атомов углерода, находящихся в состоянии гибридизации sp 3 . Они связаны между собой исключительно ковалентными сигма-связями. Название «предельные» или «насыщенные» углеводороды исходит из того факта, что эти соединения не имеют возможности присоединять какие-либо атомы. Они предельны, полностью насыщены. Исключение составляют циклоалканы.
Что такое алканы?
Алканы - это углеводороды предельные, а их углеродная цепь незамкнута и состоит из атомов углерода, связанных между собой при помощи одинарных связей. Она не содержит иных (то есть двойных, как у алкенов, или же тройных, как у алкилов) связей. Алканы также называют парафинами. Это название они получили, так как общеизвестные парафины являются смесью преимущественно данных предельных углеводородов С 18 -С 35 с особой инертностью.
Общие сведения об алканах и их радикалах
Их формула: С n Р 2 n +2 , здесь n больше или равно 1. Молярная масса вычисляется по формуле: М = 14n + 2. Характерная особенность: окончания в их названиях - «-ан». Остатки их молекул, которые образуются в результате замещения водородных атомов на иные атомы, имеют название алифатических радикалов, или алкилов. Их обозначают буквой R. Общая формула одновалентных алифатических радикалов: С n Р 2 n +1 , здесь n больше или равно 1. Молярная масса алифатических радикалов вычисляется по формуле: М = 14n + 1. Характерная особенность алифатических радикалов: окончания в названиях «-ил». Молекулы алканов имеют свои особенности строения:
- связь С-С характеризуется длиной 0,154 нм;
- связь С-Н характеризуется длиной 0,109 нм;
- валентный угол (угол между связями углерод-углерод) равен 109 градусов и 28 минут.

Начинают гомологический ряд алканы: метан, этан, пропан, бутан и так далее.
Физические свойства алканов
Алканы - это вещества, которые не имеют цвета и нерастворимы в воде. Температура, при которой алканы начинают плавиться, и температура, при которой они закипают, повышаются в соответствии с увеличением молекулярной массы и длины углеводородной цепи. От менее разветвленных к более разветвленным алканам температуры кипения и плавления понижаются. Газообразные алканы способны гореть бледно-голубым либо бесцветным пламенем, при этом выделяется довольно много тепла. СН 4 -С 4 Н 10 представляют собой газы, у которых отсутствует также и запах. С 5 Н 12 -С 15 Н 32 - это жидкости, которые обладают специфическим запахом. С 15 Н 32 и так далее - это твердые вещества, которые также не имеют запаха.
Химические свойства алканов
Данные соединения являются малоактивными в химическом плане, что можно объяснить прочностью трудноразрываемых сигма-связей - С-С и С-Н. Также стоит учитывать, что связи С-С неполярны, а С-Н малополярны. Это малополяризуемые виды связей, относящиеся к сигма-виду и, соответственно, разрываться по наибольшей вероятности они станут по механизму гомолитическому, в результате чего будут образовываться радикалы. Таким образом, химические свойства алканов в основном ограничиваются реакциями радикального замещения.

Реакции нитрования
Алканы взаимодействуют только с азотной кислотой с концентрацией 10% либо с оксидом четырехвалентного азота в газовой среде при температуре 140°С. Реакция нитрования алканов носит название реакции Коновалова. В результате образуются нитросоединения и вода: CH 4 + азотная кислота (разбавленная) = CH 3 - NO 2 (нитрометан) + вода.
Реакции горения
Предельные углеводороды очень часто применяются как топливо, что обосновано их способностью к горению: С n Р 2n+2 + ((3n+1)/2) O 2 = (n+1) H 2 O + n СО 2 .
Реакции окисления
В химические свойства алканов также входит их способность к окислению. В зависимости от того, какие условия сопровождают реакцию и как их изменяют, можно из одного и того же вещества получить различные конечные продукты. Мягкое окисление метана кислородом при наличии катализатора, ускоряющего реакцию, и температуры около 200 °С может дать в результате следующие вещества:
1) 2СН 4 (окисление кислородом) = 2СН 3 ОН (спирт - метанол).
2) СН 4 (окисление кислородом) = СН 2 О (альдегид - метаналь или формальдегид) + Н 2 О.
3) 2СН 4 (окисление кислородом) = 2НСООН (карбоновая кислота - метановая или муравьиная) + 2Н 2 О.

Также окисление алканов может производиться в газообразной или жидкой среде воздухом. Такие реакции приводят к образованию высших жирных спиртов и соответствующих кислот.
Отношение к нагреванию
При температурах, не превышающих +150-250°С, обязательно в присутствии катализатора, происходит структурная перестройка органических веществ, которая заключается в изменении порядка соединения атомов. Данный процесс называется изомеризацией, а вещества, полученные в результате реакции - изомерами. Таким образом, из нормального бутана получается его изомер - изобутан. При температурах 300-600°С и наличии катализатора происходит разрыв связей С-Н с образованием молекул водорода (реакции дегидрирования), молекул водорода с замыканием углеродной цепи в цикл (реакции циклизации или ароматизации алканов):
1) 2СН 4 = С 2 Н 4 (этен) + 2Н 2.
2) 2СН 4 = С 2 Н 2 (этин) + 3Н 2.
3) С 7 Н 16 (нормальный гептан) = С 6 Н 5 - СН 3 (толуол) + 4Н 2 .

Реакции галогенирования
Такие реакции заключаются во введении в молекулу органического вещества галогенов (их атомов), в результате чего образуется связь С-галоген. При взаимодействии алканов с галогенами образуются галогенпроизводные. Данная реакция обладает специфическими особенностями. Она протекает по механизму радикальному, и чтобы ее проинициировать, необходимо на смесь галогенов и алканов воздействовать ультрафиолетовым излучением или же просто нагреть ее. Свойства алканов позволяют реакции галогенирования протекать, пока не будет достигнуто полное замещение на атомы галогена. То есть хлорирование метана не закончится одной стадией и получением метилхлорида. Реакция пойдет далее, будут образовываться все возможные продукты замещения, начиная с хлорметана и заканчивая тетрахлорметаном. Воздействие хлора при данных условиях на другие алканы приведет к образованию различных продуктов, полученных в результате замещения водорода у различных атомов углерода. От температуры, при которой идет реакция, будет зависеть соотношение конечных продуктов и скорость их образования. Чем длиннее углеводородная цепь алкана, тем легче будет идти данная реакция. При галогенировании сначала будет замещаться атом углерода наименее гидрированый (третичный). Первичный вступит в реакцию после всех остальных. Реакция галогенирования будет происходить поэтапно. На первом этапе заместиться только один атом водорода. C растворами галогенов (хлорной и бромной водой) алканы не взаимодействуют.

Реакции сульфохлорирования
Химические свойства алканов также дополняются реакцией сульфохлорирования (она носит название реакции Рида). При воздействии ультрафиолетового излучения алканы способны реагировать со смесью хлора и диоксида серы. В результате образуется хлороводород, а также алкильный радикал, который присоединяет к себе диоксид серы. В результате получается сложное соединение, которое становится стабильным благодаря захвату атома хлора и разрушения очередной его молекулы: R-H + SO 2 + Cl 2 + ультрафиолетовое излучение = R-SO 2 Cl + HCl. Образовавшиеся в результате реакции сульфонилхлориды находят широкое применение в производстве поверхностно-активных веществ.
Алканы (метан и его гомологи) имеют общую формулу C n H 2n +2. Первые четыре углеводорода называют метан, этан, пропан, бутан. Названия высших членов этого ряда состоят из корня – греческого числительного и суффикса -ан. Названия алканов положены в основу номенклатуры IUPAC.Правила систематической номенклатуры:
- Правило главной цепи.
Главную цепь выбирают, руководствуясь последовательно следующими критериями:
- Максимальное число функциональных заместителей.
- Максимальное число кратных связей.
- Максимальная протяженность.
- Максимальное число боковых углеводородных групп.
- Правило наименьших номеров (локантов).
Главную цепь нумеруют от одного конца до другого арабскими цифрами. Каждый заместитель получает номер того атома углерода главной цепи, к которому он присоединен. Последовательность нумерации выбирают таким образом, чтобы сумма номеров заместителей (локантов) была наименьшей. Это правило применяется и при нумерации моноциклических соединений.
- Правило радикалов.
Все углеводородные боковые группы рассматривают как одновалентные (односвязные) радикалы. Если боковой радикал сам содержит боковые цепи, то в нем по приведенным выше правилам выбирается дополнительная главная цепь, которая нумеруется, начиная с атома углерода, присоединенного к главной цепи.
- Правило алфавитного порядка.
Название соединения начинают с перечисления заместителей, указывая их названия в алфавитном порядке. Названию каждого заместителя предшествует его номер в главной цепи. Наличие нескольких заместителей обозначают префиксами-числителями: ди-, три-, тетра- и т. д. После этого называют углеводород, соответствующий главной цепи.
В табл. 12.1 приведены названия первых пяти углеводородов, их радикалов, возможных изомеров и соответствующие им формулы. Названия радикалов заканчиваются суффиксом -ил.
|
||||||||||||||||||||||||||||||||||||
Таблица 12.1. Алканы ациклопического ряда C n H 2 n +2 . |
||||||||||||||||||||||||||||||||||||
Пример. Назвать все изомеры гексана.
Пример. Назвать алкан следующего строения
В этом примере из двух двенадцатиатомных цепей выбрана та, в которой сумма номеров наименьшая (правило 2).
Используя названия разветвленных радикалов, приведенных в табл. 12.2,
|
||||||||||||||||||||
Таблица 12.2. Названия развлетвленных радикалов. |
название этого алкана несколько упрощается:
10-трет-бутил-2,2-(диметил)-7-пропил-4-изопропил-3-этил-додекан.
При замыкании углеводородной цепи в цикл с потерей двух атомов водорода образуются моноциклоалканы с общей формулой C n H 2n . Циклизация начинается с C 3, названия образуются от C n с префиксом цикло:
Полициклические алканы. Их названия образуются посредством приставки бицикло-, трицикло- и т. д. Бициклические и трициклические соединения содержат соответственно два и три цикла в молекуле, для описания их строения в квадратных скобках указывают в порядке уменьшения число атомов углерода в каждой из цепей, соединяющих узловые атомы; под формулой название атома:
Этот трициклический углеводород обычно называют адамантаном (от чешского адамант – алмаз), поскольку он представляет комбинацию трех сконденсированных циклогексановых колец в форме, приводящей к такому расположению атомов углерода в кристаллической решетке, которое свойственно алмазу.
Циклические углеводороды с одним общим атомом углерода называются спиранами, например, спиро-5,5-ундекан:
Плоские циклические молекулы неустойчивы, поэтому образуются различные конформационные изомеры. В отличие от конфигурационных изомеров (пространственное расположение атомов в молекуле без учета ориентации) конформационные изомеры различаются между собой только поворотом атомов или радикалов вокруг формально простых связей при сохранении конфигурации молекул. Энергия образования стабильного конформера называется конформационной .
Конформеры находятся в динамическом равновесии и превращаются друг в друга через нестабильные формы. Неустойчивость плоских циклов вызвана значительной деформацией валентных углов. При сохранении тетраэдрических валентных углов для циклогексана C 6H 12 возможны две устойчивые конформации: в форме кресла (а) и в форме ванны (б):
|
I. АЛКАНЫ (предельные углеводороды, парафины)
Алканы – алифатические (ациклические) предельные углеводороды, в которых атомы углерода связаны между собой простыми (одинарными) связями в неразветвленные или разветвленные цепи. Алканы
– название предельных углеводородов по международной номенклатуре. Простейшие представители алканов: При сравнении этих соединений видно, что они отличаются друг от друга на группу -СН 2 - (метилен ). Добавляя к пропану еще одну группу -СН 2 - , получим бутан С 4 Н 10 , затем алканы С 5 Н 12 , С 6 Н 14 и т.д. Теперь можно вывести общую формулу алканов. Число атомов углерода в ряду алканов примем за n
, тогда число атомов водорода составит величину 2n+2
. Следовательно, состав алканов соответствует общей формуле C n H 2n+2
.
II. Строение алканов
Последние материалы раздела: 
Николай Алексеевич НекрасовГод написания: 1870Жанр произведения: поэмаГлавные герои: мальчик Саша и его дед-декабрист Очень коротко основную... 
Рис. 99. Задания к графической работе № 4 3) Есть ли отверстия в детали? Если есть, какую геометрическую форму отверстие имеет? 4) Найдите на... 
Чешская система образования развивалась на протяжении длительного периода. Обязательное образование было введено с 1774 года. На сегодняшний день в... |
