Алкены кратко. Общая формула и виды изомерии алкенов
Алкены — это непредельные углеводороды , которые имеют одну двойную связь между атомами . Другое их название это олефины, оно связано с историей открытия этого класса соединений. В основном в природе эти вещества не встречаются, а синтезируются человеком для практических целей. В номенклатуре ИЮПАК название этих соединений формируется по тому же принципу, что и для алканов, только суффикс “ан” заменяется на “ен”.
Вконтакте
Строение алкенов
Два атома углерода, участвующих в образовании двойной связи, всегда находятся в sp2 гибридизации, и угол между ними равен 120 градусам. Двойная связь образована с помощью перекрывания π -π орбиталей, а оно не очень прочное, поэтому данную связь достаточно просто разорвать, что находит применение в химических свойствах веществ.
Изомерия
По сравнению с предельными, в этих углеводородах возможно больше видов , при том как пространственной, так и структурной. Структурная изомерия может также подразделяться на несколько видов.
Первый также существует и для алканов, и заключается в различном порядке соединения атомов углерода. Так изомерами могут быть пентен-2 и 2-метилбутен-2. А второй — это изменение положения двойной связи.
Пространственная изомерия в этих соединениях возможна благодаря появлению двойной связи. Она бывает двух видов — геометрической и оптической.
Геометрическая изомерия — один из самых распространенных в природе видов, при том практически всегда геометрические изомеры будут иметь кардинально разные физические и химические свойства. Различают цис и транс изомеры. У первых — заместители располагаются с одной стороны от кратной связи, а у транс изомеров они находятся в разных плоскостях.
Получение алкенов
 Впервые получены они были, как и много других веществ, совершенно случайно.
Впервые получены они были, как и много других веществ, совершенно случайно.
Немецкий химик и исследователь Бехер в конце 17 века изучал действие серной кислоты на этиловый спирт и понял, что получил неизвестный газ , который при этом является более реакционноспособным, чем метан.
Позже подобные исследования провели еще несколько ученых, они же и узнали, что данный газ при взаимодействии с хлором образует маслянистое вещество.
Поэтому первоначально этому классу соединений было присвоено название олефины, что переводится как маслородный. Но все же определить состав и строение данного соединения у ученых не получалось. Это произошло только почти спустя два века, в конце девятнадцатого столетия.
В настоящее время существует много способов получения алкенов.
Промышленные способы
Получение промышленными методами :
- Дегидрирование предельных углеводородов. Данная реакция возможна только при действии высоких температур (около 400 градусов) и катализаторов — либо оксида хрома 3, либо алюмоплатиновых катализаторов.
- Дегалогенирование дигалогеноалканов. Происходит только в присутствии цинка или магния, и при высоких температурах.
- Дегидрогалогенирование галогеноалканов. Проводится при помощи натриевых или калиевых солей органических кислот при повышенной температуре.
Важно ! Данные способы получения алкенов не дают чистого продукта, результатом реакции будет смесь непредельных углеводородов. Преобладающее среди них соединение определяется с помощью правила Зайцева. Оно гласит, что водород отщепляется с наибольшей вероятностью от атома углерода у которого меньше всего связей с водородами.
Дегидратация спиртов. Может проводиться только при нагревании и в присутствии растворов сильных минеральных кислот, обладающих водоотнимающим свойством.
Гидрирование алкинов. Возможно только в присутствии паладиевых катализаторов.
Химические свойства алкенов
Алкены являются очень химически активными веществами. Во многом это объясняется благодаря наличию двойной связи. Самыми характерными реакциями для этого класса соединений являются электрофильное и радикальное присоединение.
- Галогенирование алкенов — относится к классическим реакциям электрофильного присоединения. Она происходит только в присутствии инертных органических растворителей, чаще всего это тетрахлорметан.
- Гидрогалогенирование. Присоединение этого типа осуществляется по правилу Марковникова. Ион присоединяется к более гидрированному атому углерода возле двойной связи, и соответственно, ион галогенида присоединяется ко второму атому углерода. Это правило нарушается в присутствии перекисных соединений — эффект Харроша. Присоединение галогеноводорода происходит полностью обратно правилу Марковникова.
- Гидроборирование. Эта реакция имеет значительную практическую важность. Поэтому ученый, который ее открыл и изучил даже получил Нобелевскую премию. Данная реакция проводится в несколько ступеней, при этом присоединение иона бора происходит не по правилу Марковникова.
- Гидратация алкенов или присоединение . Данная реакция также протекает согласно правилу Марковникова. Гидроксид-ион присоединяется к наименее гидрированному атому углерода при двойной связи.
- Алкилирование — еще одна реакция часто применяемая в промышленности. Она заключается в присоединении предельных углеводородов к непредельным под воздействием низких температур и катализаторов, с целью увеличения атомной массы соединений. Катализатором чаще всего выступают сильные минеральные кислоты. Также эта реакция может протекать и по свободнорадикальному механизму.
- Полимеризация алкенов — еще одна нехарактерная для предельных углеводородов реакция. Она подразумевает соединение между собой многочисленных молекул с целью образования прочного соединения, отличающегося по своим физическим свойствам.
 n в данной реакции это количество молекул, вступивших в связь. Обязательным условием осуществления является кислая среда, повышенная температура и увеличенное давление.
n в данной реакции это количество молекул, вступивших в связь. Обязательным условием осуществления является кислая среда, повышенная температура и увеличенное давление.
Также для алкенов характерны и другие реакции электрофильного присоединения, которые не получили такого обширного практического распространения.
Например, реакция присоединения спиртов, с образованием простых эфиров.
Или присоединение хлорангидридов, с получением непредельных кетонов — реакция Кондакова.
Обратите внимание! Данная реакция возможна только в присутствии катализатора хлорида цинка.
Следующий крупный класс реакций характерный для алкенов это реакции радикального присоединения. Данные реакции возможны только при образовании свободных радикалов под воздействием высоких температур, облучения и других действий. Самая характерная реакция радикального присоединения это гидрирование с образованием предельных углеводородов. Она происходит исключительно под воздействием температур и в присутствии платинового катализатора.
Благодаря наличию двойной связи, для алкенов очень характерными являются различные реакции окисления .
- Горение — классическая реакция окисления. Она хорошо идет без катализаторов. В зависимости от количества кислорода возможны разные конечные продукты: от углекислого газа и до углерода.
- Окисление перманганатом калия в нейтральной среде. Продуктами являются многоатомные спирты и бурый осадок диоксида марганца. Данная реакция считается качественной для алкенов.
- Также мягкое окисление может осуществляться пероксидом водорода, оксидом осмия 8, и другими окислителями в нейтральной среде. Для мягкого окисления алкенов характерен разрыв только одной связи, продуктом реакции, как правило, являются многоатомные спирты.
- Также возможно и жесткое окисление, при котором происходит разрыв обеих связей и образуются кислоты или кетоны. Обязательным условием является кислая среда, чаще всего используют серную кислоту, так как другие кислоты могут также подвергаться окислению с образованием побочных продуктов.
4. Химические свойства алкенов
Энергия двойной углерод-углеродной связи в этилене (146 ккал/моль) оказывается значительно более низкой, чем удвоенная энергия одинарной С-С-связи в этане (2 88=176 ккал/моль). -Связь С-С в этилене прочнее -связи, поэтому реакции алкенов, сопровождающиеся разрывом -связи с образованием двух новых простых -связей, представляют собой термодинамически благоприятный процесс. Так, например, в газовой фазе согласно расчетным данным все приведенные ниже реакции являются экзотермическими со значительной отрицательной энтальпией, независимо от их реального механизма.
С точки зрения теории молекулярных орбиталей также можно сделать вывод о большей реакционной способности -связи по сравнению с -связью. Рассмотрим молекулярные орбитали этилена (рис. 2).

Действительно, связывающая -орбиталь этилена имеет более высокую энергию, чем связывающая -орбиталь, и наоборот, разрыхляющая *-орбиталь этилена лежит ниже разрыхляющей *-орбитали связи С=С. В обычных условиях *- и *-орбитали этилена вакантны. Следовательно, граничными орбиталями этилена и других алкенов, определяющими их реакционную способность будут -орбитали.
4.1. Каталитическое гидрирование алкенов
Несмотря на то, что гидрирование этилена и других алкенов до алканов, сопровождается выделением тепла, эта реакция с заметной скоростью идет только в присутствии определенных катализаторов. Катализатор, по определению, не влияет на тепловой эффект реакции, и его роль сводится к понижению энергии активации. Следует различать гетерогенное и гомогенное каталитическое гидрирование алкенов. В гетерогенном гидрировании используются тонкоизмельченные металлические катализаторы - платина, палладий, рутений, родий, осмий и никель либо в чистом виде, либо нанесенные на инертные носители - BaSO 4 , CaCO 3 , активированный уголь, Al 2 O 3 и т. д. Все они нерастворимы в органических средах и действуют как гетерогенные катализаторы. Наибольшую активность среди них проявляют рутений и родий, но наибольшее распространение получил платина и никель. Платину обычно применяют в виде черного диоксида PtO 2 , широко известного под названием "катализатора Адамса". Диоксид платины получают при сплавлении платинохлористоводородной кислоты H 2 PtCl 6 . 6H 2 O или гексахлорплатината аммония (NH 4) 2 PtCl 6 с нитратом натрия. Гидрирование алкенов с катализатором Адамса проводят обычно при нормальном давлении и температуре 20-50 0 С в спирте, уксусной кислоте, этилацетате. При пропускании водорода двуокись платины восстанавливается непосредственно в реакционном сосуде до платиновой черни, которая и катализирует гидрирование. Другие более активные металлы платиновой группы используют на инертных носителях, например, Pd/C или Pd/BaSO 4 , Ru/Al 2 O 3 ; Rh/C и др. Палладий, нанесенный на уголь, катализирует гидрирование алкенов до алканов в спиртовом растворе при 0-20 0 С и нормальном давлении. Никель обычно используется в виде так называемого "никеля Ренея". Для получения этого катализатора сплав никеля с алюминием обрабатывают горячей водной щелочью для удаления почти всего алюминия и далее водой до нейтральной реакции. Катализатор имеет пористую структуру, и поэтому называется также скелетным никелевым катализатором. Типичные условия гидрирования алкенов над никелем Ренея требуют применения давления порядка 5-10 атм и температуры 50-100 0 С, т. е. этот катализатор значительно менее активен, чем металлы платиновой группы, но он белее дешев. Ниже приведены некоторые типичные примеры гетерогенного каталитического гидрирования ациклических и циклических алкенов:


Так как оба атома водорода присоединяются к атомам углерода двойной связи с поверхности металла-катализатора, обычно присоединение происходит с одной стороны двойной связи. Этот тип присоединения называется син -присоединением. В тех случаях когда два фрагмента реагента присоединяются с различных сторон кратной связи (двойной или тройной) имеет место анти -присоединение. Термины син - и анти - по смыслу эквивалентны терминам цис - и транс -. Для того, чтобы избежать путаницы и недоразумений термины син - и анти - относятся к типу присоединения, а термины цис - и транс - к строению субстрата.
Двойная связь в алкенах гидрируется с большей скоростью по сравнению со многими другими функциональными группами (С=О, COOR, CN и др.) и поэтому гидрирование двойной связи С=С часто представляет собой селективный процесс, если гидрирование ведется в мягких условиях (0-20 0 С и при атмосферном давлении). Ниже приведены некоторые типичные примеры:


Бензольное кольцо не восстанавливается в этих условиях.
Большим и принципиально важным достижением в каталитическом гидрировании является открытие растворимых комплексов металлов, которые катализируют гидрирование в гомогенном растворе. Гетерогенное гидрирование на поверхности металлических катализаторов имеет ряд существенных недостатков, таких, как изомеризация алкенов и расщепление одинарных углерод-углеродных связей (гидрогенолиз). Гомогенное гидрирование лишено этих недостатков. За последние годы получена большая группа катализаторов гомогенного гидрирования - комплексов переходных металлов, содержащих различные лиганды. Лучшими катализаторами гомогенного гидрирования являются комплексы хлоридов родия (I) и рутения (III) с трифенилфосфином - трис(трифенилфосфин)родийхлорид (Ph 3 P) 3 RhCl (катализатор Уилкинсона) и гидрохлорид трис(трифенилфосфин)рутения (Ph 3 P) 3 RuHCl. Наиболее доступен родиевый комплекс, который получается при взаимодействии хлорида родия (III) с трифенилфосфином. Родиевый комплекс Уилкинсона используется для гидрирования двойной связи в обычных условиях.

Важное преимущество гомогенных катализаторов заключается в возможности селективного восстановления моно- или дизамещенной двойной связи в присутствии три- и тетразамещенной двойной связи из-за больших различий в скорости их гидрирования.

В случае гомогенных катализаторов присоединение водорода также происходит как син -присоединение. Так восстановление цис -бутена-2 дейтерием в этих условиях приводит к мезо -2,3-дидейтеробутану.

4.2. Восстановление двойной связи с помощью диимида
Восстановление алкенов до соответствующих алканов может быть с успехом осуществлено с помощью диимида NH=NH.
Диимид получают двумя основными методами: окислением гидразина пероксидом водорода в присутствии ионов Cu 2+ или взаимодействием гидразина с Ni-Ренея (дегидрирование гидразина). Если в реакционной смеси присутствует алкен, его двойная связь под действием очень нестабильного диимида подвергается гидрированию. Отличительной особенностью этого метода является строгая син -стереоспецифичность процесса восстановления. Полагают, что эта реакция протекает через циклический активированный комплекс со строгой ориентацией обеих реагирующих молекул в пространстве.

4.3. Реакции электрофильного присоединения по двойной связи алкенов
Граничными орбиталями ВЗМО и НСМО алкенов являются занятая - и пустая *-орбитали. Следовательно, в реакциях с электрофилами (Е +) будет участвовать -орбиталь, а в реакциях с нуклеофилами (Nu -) - *-орбиталь связи С=С (см. рис. 3). В большинстве случаев простые алкены легко вступают в реакции с электрофилами, а с нуклеофилами реагируют с большим трудом. Это объясняется тем, что обычно НСМО большинства электрофилов по энергии близки к энергии -ВЗМО алкенов, тогда как ВЗМО большинства нуклеофилов лежат значительно ниже *-НСМО.

Простые алкены реагируют лишь с очень сильными нуклеофильными агентами (карбанионы) в жестких условиях, однако введение электроноакцепторных групп в алкены, например, NO 2 , COR и др., приводит к понижению *-уровня, благодаря чему алкен приобретает способность реагировать с нуклеофилами средней силы (аммиак, RO - , Nє C - , енолят-анион и т. д.).
В результате взаимодействия электрофильного агента Е + с алкеном образуется карбокатион, обладающий высокой реакционной способностью. Карбокатион далее стабилизируется за счет быстрого присоединения нуклеофильного агента Nu - :


Поскольку медленной стадией является присоединение электрофила, то процесс присоединения любого полярного агента Е + Nu - следует рассматривать именно как электрофильное присоединение к кратной связи алкена. Известно большое число реакций этого типа, где роль электрофильного агента выполняют галогены, галогеноводороды, вода, соли двухвалентной ртути и другие полярные реагенты. Электрофильное присоединение к двойной связи в классификации механизмов органических реакций имеет символ Аd E (Addition Electrophilic ) и в зависимости от числа реагирующих молекул обозначается как Аd E 2 (бимолекулярная реакция) или Аd E 3 (тримолекулярная реакция).
4.3.а. Присоединение галогенов
Алкены реагируют с бромом и хлором с образованием продуктов присоединения по двойной связи одной молекулы галогена с выходом близким к количественному. Фтор слишком активен и вызывает деструкцию алкенов. Присоединение йода к алкенам в большинстве случаев представляет собой обратимую реакцию, равновесие которой смещено в сторону исходных реагентов.



Быстрое обесцвечивание раствора брома в СCl 4 служит одним из простейших тестов на ненасыщенность, поскольку и алкены, и алкины, и диены быстро реагируют с бромом.
Присоединение брома и хлора к алкенам происходит по ионному, а не по радикальному механизму. Этот вывод следует из того, что скорость присоединения галогена не зависит от облучения, присутствия кислорода и других реагентов, инициирующих или ингибирующих радикальные процессы. На основании большого числа экспериментальных данных для этой реакции был предложен механизм, включающий несколько последовательных стадий. На первой стадии происходит поляризация молекулы галогена под действием электронов -связи. Атом галогена, приобретающий некоторый дробный положительный заряд, образует с электронами -связи нестабильный интермедиат, называемый -комплексом или комплексом с переносом заряда. Следует отметить, что в -комплексе галоген не образует направленной связи с каким-нибудь конкретным атомом углерода; в этом комплексе просто реализуется донорно-акцепторное взаимодействие электронной пары -связи как донора и галогена как акцептора.

Далее -комплекс превращается в циклический бромониевый ион. В процессе образования этого циклического катиона происходит гетеролитический разрыв связи Br-Br и пустая р -орбиталь sp 2 -гибридизованного атома углерода перекрывается с р -орбиталью "неподеленной пары" электронов атома галогена, образуя циклический ион бромония.

На последней, третьей стадии анион брома как нуклеофильный агент атакует один из атомов углерода бромониевого иона. Нуклеофильная атака бромид-иона приводит к раскрытию трехчленного цикла и образованию вицинального дибромида (vic -рядом). Эту стадию формально можно рассматривать как нуклеофильное замещение S N 2 у атома углерода, где уходящей группой является Br+ .

Присоединение галогенов к двойной связи алкенов представляет собой одну из формально простых модельных реакций, на примере которой можно рассмотреть влияние основных факторов, позволяющих сделать аргументированные выводы о детальном механизме процесса. Для обоснованных выводов о механизме любой реакции следует располагать данными по: 1) кинетике реакции; 2) стереохимии (стереохимический результат реакции); 3) наличию или отсутствию сопряженного, конкурирующего процесса; 4) влиянию заместителей в исходном субстрате на скорость реакции; 5) использованию меченых субстратов и (или) реагентов; 6) возможности перегруппировок в ходе реакции; 7) влиянию растворителя на скорость реакции.
Рассмотрим эти факторы на примере галогенирования алкенов. Кинетические данные дают возможность установить порядок реакции по каждому компоненту и на этом основании сделать вывод об общей молекулярности реакции, т. е. о числе реагирующих молекул.
Для бромирования алкенов скорость реакции как правило описывается следующим уравнением:
v = k`[алкен] + k``[алкен] 2 ,
которое в редких случаях упрощается до
v = k`[алкен].
На основании кинетических данных можно сделать вывод о том, что в определяющей скорость стадии принимает участие одна или две молекулы брома. Второй порядок по брому означает, что с бромониевым ионом реагирует не бромид-ион Br - , а трибромид-ион , образующийся при взаимодействии брома и бромид-иона:
![]()
Это равновесие сдвинуто вправо. Кинетические данные не позволяют сделать какие-либо другие выводы о структуре переходного состояния и природе электрофильной частицы в реакции присоединения галогена по двойной связи. Наиболее ценную информацию о механизме этой реакции представляют данные по стереохимии присоединения. Присоединение галогена к двойной связи представляет собой стереоспецифический процесс (процесс, в котором образуется только один из возможных стереоизомеров; в стереоселективном процессе наблюдается преимущественное образование одного стереомера) анти -присоединения для алкенов и циклоалкенов, у которых двойная связь не сопряжена с бензольным кольцом. Для цис - и транс -изомеров бутена-2, пентена-2, гексена-3, циклогексена, циклопентена и других алкенов присоединение брома происходит исключительно как анти -присоединение. При этом в случае циклогексена образуется исключительно транс -1,2-дибромциклогексан (смесь энантиомеров).

Транс-расположение атомов брома в 1,2-дибромциклогексане можно упрощенно изобразить относительно средней плоскости циклогексанового кольца (без учета конформаций ):
При присоединении брома к циклогексену первоначально образуется транс -1,2-дибромциклогексан в а,а -конформации, которая затем сразу же переходит в энергетически более выгодную е,е -конформацию. Анти -присоединение галогенов к двойной связи позволяет отвергнуть механизм одностадийного синхронного присоединения одной молекулы галогена к двойной связи, которое может осуществляться только как син -присоединение. Анти -присоединение галогена не согласуется также и с образованием открытого карбкатиона RCH + -CH 2 Hal в качестве интермедиата. В открытом карбокатионе возможно свободное вращение вокруг С-С-связи, что должно приводить после атаки аниона Br - к образованию смеси продуктов как анти -, так и син -присоединения. Стереоспецифическое анти -присоединение галогенов явилось главной причиной создания концепции бромониевого или хлорониевого ионов в качестве дискретных промежуточных частиц. Эта концепция идеально удовлетворяет правилу анти -присоединения, поскольку нуклеофильная атака галогенид-иона возможна с анти -стороны по любому из двух атомов углерода галогенониевого иона по S N 2 механизму.

В случае несимметрично замещенных алкенов это должно приводить к двум энантиомерам трео -формы при присоединении брома к цис -изомеру или к энантиомерам эритро -формы при галоидировании транс -изомера. Это действительно наблюдается при присоединении брома, например, к цис - и транс -изомерам пентена-2.




В случае бромирования симметричных алкенов, например, цис - или транс -гексенов-3 должны образоваться или рацемат (D,L -форма), или мезо -форма конечного дибромида, что и наблюдается в действительности.




Имеется независимое, прямое доказательство существования галогенониевых ионов в ненуклеофильной, индифферентной среде при низкой температуре. С помощью ЯМР-спектроскопии было зарегистрировано образование бромониевых ионов при ионизации 3-бром-2-метил-2-фторбутана при действии очень сильной кислоты Льюиса пятифтористой сурьмы в растворе жидкой двуокиси серы при -80 0 С.

Этот катион достаточно стабилен при -80 0 С в ненуклеофильной среде, но мгновенно разрушается при действии любых нуклеофильных агентов или при нагревании.
Циклические ионы бромония иногда могут быть выделены в чистом виде, если пространственные препятствия мешают их раскрытию при действии нуклеофилов:

Понятно, что возможность существования довольно стабильных в специальных условиях бромониевых ионов не может служить прямым доказательством их образования в реакции присоединения брома к двойной связи алкена в спирте, уксусной кислоте и других электронодонорных растворителях. Такие данные следует рассматривать лишь как независимое подтверждение принципиальной возможности образования галогенониевых ионов в процессе электрофильного присоединения по двойной связи.
Концепция галогенониевых иона позволяет дать рациональное объяснение обратимости присоединения йода к двойной связи. В катионе галогенония есть три электрофильных центра, доступных нуклеофильной атаке галогенид-аниона: два атома углерода и атом галогена. В случае хлорониевых ионов, анион Cl - , по-видимому, преимущественно или даже исключительно атакует углеродные центры катиона. Для бромониевого катиона равно вероятны оба направления раскрытия галогенониевого иона как за счет атаки бромид-иона по обоим атомам углерода, так и по атому брома. Нуклеофильная атака по атому брома бромониевого иона приводит к исходным реагентам брому и алкену:

Иодониевый ион раскрывается преимущественно в результате атаки иодид-иона по атому йода, и поэтому равновесие между исходными реагентами и иодониевым ионом смещено влево.

Кроме того, конечный продукт присоединения - вицинальный дииодид может подвергаться нуклеофильной атаке по атому йода присутствующим в растворе трииодид-анионом , что также приводит к образованию исходных реагентов алкена и иода. Другими словами, в условиях реакции присоединения происходит деиодирование образующегося вицинального дииодида под действием трииодид-аниона. Вицинальные дихлориды и дибромиды не дегалогенируются в условиях реакции присоединения соответственно хлора или брома к алкенам.
Анти-присоединение хлора или брома характерно для алкенов, у которых двойная связь не сопряжена с -электронами бензольного кольца. Для стирола, стильбена и их производных наряду с анти -присоединением имеет место и син -присоединение галогена, которое в полярной среде может стать даже доминирующим.


В тех случаях, когда присоединение галогена к двойной связи проводится в среде нуклеофильных растворителей, растворитель эффективно конкурирует с галогенид-ионом при раскрытии трехчленного цикла галогенониевого иона:

Образование продуктов присоединения с участием растворителя или какого-либо иного "внешнего" нуклеофильного агента носит название реакции сопряженного присоединения. При взаимодействии брома и стирола в метаноле образуется два продукта: вицинальный дибромид и бромэфир, соотношение которых зависит от концентрации брома в метаноле
В сильно разбавленном растворе доминирует продукт сопряженного присоединения, а в концентрированном растворе, напротив, преобладающий вицинальный дибромид. В водном растворе всегда преобладает галогенгидрин (спирт, содержащий галоген при -углеродном атоме) - продукт сопряженного присоединения.

ее-Конформер транс -2-хлорциклогексанола дополнительно стабилизирован водородной связью О-Н . . . Cl. В случае несимметричных алкенов в реакциях сопряженного присоединения галоген всегда присоединяется к атому углерода, содержащему наибольшее количество атомов водорода, а нуклеофильный агент к углероду с меньшим количеством атомов водорода. Изомерный продукт с иным расположением присоединяющихся групп не образуется. Это означает, что образующийся в качестве интермедиата циклический галогенониевый ион должен иметь несимметричную структуру с двумя различающимися по энергии и прочности связями С 1 -Hal и С 2 -Hal и большим положительным зарядом на внутреннем атоме углерода С 2 , что можно графически выразить двумя способами:

Поэтому нуклеофильной атаке растворителем подвергается атом углерода С 2 галогенониевого иона несмотря на то, что он более замещен и стерически менее доступен.


Один из лучших препаративных методов синтеза бромгидринов заключается в гидроксибромировании алкенов с помощью N-бромсукцинимида ( NBS ) в бинарной смеси диметилсульфоксида (ДМСО ) и воды.

Данную реакцию можно проводить в воде и без ДМСО , однако выходы бромгидринов в этом случае несколько ниже.



Образование продуктов сопряженного присоединения в реакции галогенирования алкенов также позволяет отвергнуть синхронный механизм присоединения одной молекулы галогена. Сопряженное присоединение к двойной связи находится в хорошем соответствии с двухстадийным механизмом с участием катиона галогенония в качестве интермедиата.
Для реакции электрофильного присоединения к двойной связи следует ожидать увеличения скорости реакции при наличии электронодонорных алкильных заместителей и ее уменьшения при наличии электроноакцепторных заместителей при двойной связи. Действительно, скорость присоединения хлора и брома к двойной связи резко возрастает при переходе от этилена к его метилзамещенным производным. Например, скорость присоединения брома к тетраметилэтилену в 10 5 раз выше, чем скорость его присоединения к бутену-1. Такое громадное ускорение определенно указывает на высокую полярность переходного состояния и высокую степень разделения зарядов в переходном состоянии и согласуется с элетрофильным механизмом присоединения.
В некоторых случаях присоединение хлора к алкенам, содержащим электронодонорные заместители, сопровождается отщеплением протона из промежуточного соединения вместо присоединения хлорид-иона. Отщепление протона приводит к образованию хлорзамещенного алкена, которое формально можно рассматривать как прямое замещение с миграцией двойной связи. Однако опыты с изотопной меткой указывают на более сложный характер происходящих здесь превращений. При хлорировании изобутилена при 0 0 С образуется 2-метил-3-хлорпропен (металлилхлорид) вместо ожидаемого дихлорида - продукта присоединения по двойной связи.

Формально как будто идет замещение, а не присоединение. Изучение этой реакции с использованием изобутилена меченного в положение 1 изотопом 14 С, показало, что прямое замещение водорода хлором не происходит, так как в образующемся металлилхлориде метка находится в группе 14 СН 2 Cl. Этот результат можно объяснить следующей последовательностью превращений:

В отдельных случаях может происходить также 1,2-миграция алкильной группы

В ССl 4 (неполярный растворитель) эта реакция дает практически 100% дихлорида Б - продукта обычного присоединения по двойной связи (без перегруппировки).
Скелетные перегруппировки подобного типа наиболее характерны для процессов с участием открытых карбокатионов в качестве промежуточных частиц. Не исключено, что присоединение хлора в этих случаях идет не через хлорониевый ион, а через катионную частицу, близкую к открытому карбокатиону. Вместе с тем следует отметить, что скелетные перегруппировки явление достаточно редкое в процессах присоединения галогенов и смешанных галогенов по двойной связи: они чаще наблюдаются при присоединении хлора и гораздо реже при присоединении брома. Вероятность таких перегруппировок увеличивается при переходе от неполярных растворителей (ССl 4) к полярным (нитрометан, ацетонитрил).
Суммируя приведенные данные по стереохимии, сопряженному присоединению, влияние заместителей в алкене, а также перегруппировкам в реакциях присоединения галогенов по двойной связи, следует отметить, что они находятся в хорошем соответствии с механизмом электрофильного присоединения с участием циклического галогенониевого иона. Таким же образом могут быть интерпретированы данные по присоединению к алкенам смешанных галогенов, для которых стадийность присоединения определяется полярностью связи двух атомов галогена.
Для алкенов характерны, прежде всего, реакции присоединения по двойной связи. В основном эти реакции идут по ионному механизму. Пи-связь разрывается, и образуются две новые сигма-связи. Напомню, что для алканов типичными были реакции замещения и шли они по радикальному механизму. Присоединяться к алкенам могут молекулы водорода, эти реакции называются гидрирование, молекулы воды, гидратация, галогены галогенирование, галогенводороды гидрогалогенирование. Но обо всем по порядку.
Реакции присоединения по двойной связи
Итак, первое химическое свойство способность присоединять галогеноводороды, гидрогалогенирование.
Пропен и остальные алкены реагируют с галогеноводородами по правилу Марковникова.

Атом водорода присоединяется к наиболее гидрированному, или правильнее сказать гидрогенизированному, атому углерода.
Вторым номером в нашем списке свойств будет гидратация, присоединение воды.
Реакция проходит при нагревании в присутствии кислоты обычно серной или фосфорной. Присоединение воды происходит также по правилу Марковникова, то есть первичный спирт можно получить только гидратацией этилена, остальные неразветвленные алкены дают вторичные спирты.
И для гидрогалогениерования и для гидратации существуют исключения из правила Марковникова. Во-первых, против этого правила присоединение протекает в присутствии пероксидов.
Во-вторых, для производных алкенов, в которых присуствуют электронноакцепторне группы. Например, для 3,3,3-трифторпропена-1.

Атомы фтора за счет высокой электроотрицательности оттягивают на себя электронную плотность по цепи сигма-связей. Такое явление называется отрицательным индуктивным эффектом.

Из-за этого происходит смещение подвижных пи-электронов двойной связи и у крайнего атома углерода оказывается частичный положительный заряд, который обычно обозначается как дельта плюс. Именно к нему и пойдет отрицательно заряженный ион брома, а катион водорода присоединится к наименее гидрированному атому углерода.
Помимо трифторметильной группы отрицательным индуктивным эффектом обладает, например, трихлорметильная группа, нитрогруппа, карбоксильная группа и некоторые другие.
Этот второй случай нарушения правила Марковникова в ЕГЭ встречается очень редко, но все-таки желательно иметь его в виду, если вы планируете сдать экзамен на максимальный балл.
Третье химическое свойство присоединение молекул галогенов.

В первую очередь это касается брома, поскольку данная реакция является качественной на кратную связь. При пропускании, например, этилена через бромную воду, то есть раствор брома в воде, имеющий коричневый цвет, происходит ее обесцвечивание. Если пропускать через бромную воду смесь газов, например, этан и этен, то можно получить чистый этан без примеси этена, поскольку тот останется в реакционной колбе в виде дибромэтана, представляющего собой жидкость.
Особым образом стоит отметить реакцию алкенов в газовой фазе при сильном нагревании, например, с хлором.
При таких условиях протекает не реакция присоединения, а реакция замещения. При чем исключительно по альфа-атому углерода, то есть атому, соседствующему с двойной связью. В данном случае получается 3-хлорпропен-1. Эти реакции на экзамене встречаются нечасто, поэтому большинство учеников их не помнит и, как правило, совершает ошибки.
Четвертым номером идет реакция гидрирования, а вместе с ней и реакция дегидрирования. То есть присоединение или отщепление водорода.

Гидрирование происходит при не очень высокой температуре на никелевом катализаторе. При более высокой температуре возможно дегидрирование с получением алкинов.
Пятым свойством алкенов является способность к полимеризации, когда сотни и тысячи молекул алкена за счет разрыва пи-связи и образования сигма-свзяей друг с другом образуют очень длинные и прочные цепочки.
В данном случае получился полиэтилен. Обратите внимание, что в получившейся молекуле кратные связи отсутствуют. Такие вещества называются полимерами, исходные молекулы называются мономерами, повторяющийся фрагмент это элементарное звено полимера, а число n степень полимеризации.
Также возможны реакции получения других важных полимерных материалов, например, полипропилена.


Еще один важный полимер поливинилхлорид.

Исходным веществом для производства этого полимера является хлорэтен, тривиальное название которого винилхлорид. Поскольку этот непредельный заместитель называется винил. Часто встречающаяся аббревиатура на пластмассовых изделиях ПВХ как раз расшифровывается как поливинилхлорид.
Мы обсудили пять свойств, которые представляли собой реакции присоединения по двойной связи. Теперь обратимся к реакциям окисления .
Реакции окисления алкенов
Шестое химическое свойство в нашем общем списке это мягкое окисление или реакция Вагнера. Оно протекает при воздействии на алкен водным раствором перманганата калия на холоду, поэтому часто в экзаменационных заданиях указывают температуру ноль градусов.
В результате получается двухатомный спирт. В данном случае этиленгликоль, а в целом такие спирты носят общее название гликоли. В процессе реакции фиолетово-розовый раствор перманганата обесцвечивается, поэтому эта реакция также является качественной на двойную связь. Марганец в нейтральной среде из степени окисления +7 восстанавливается до степени окисления +4. Рассмотрим еще несколько примеров. УРАВНЕНИЕ
Здесь получился пропандиол-1,2. Однако таким же образом будут реагировать и циклические алкены. УРАВНЕНИЕ
Еще один вариант, когда двойная связь находится, например, в боковой цепи ароматических углеводородов. Регулярно в заданиях егэ встречается реакция Вагнера с участием стирола, его второе название винилбензол.

Я надеюсь, что представил вашему вниманию достаточно примеров, чтобы вы поняли, что мягкое окисление двойной связи всегда подчиняется довольно простому правилу пи-связь разрывается и к каждому атому углерода присоединяется гидроксигруппа.
Теперь, что касается жесткого окисления. Это будет наше седьмое свойство. Такое окисление происходит, когда алкен реагирует с кислотным раствором перманганата калия при нагревании.
Происходит деструкция молекулы, то есть ее разрушение по двойной связи. В случае бутена-2 получились две молекулы уксусной кислоты. В целом же, по продуктам окисления можно судить о положении кратной связи в углеродной цепи.
При окислении бутена-1 получается молекула пропионовой (пропановой) кислоты и углекислый газ.
В случае этилена получится две молекулы углекислого газа. Во всех случаях в кислой среде марганец из степени окисления +7 восстанавливается до +2.
И, наконец, восьмое свойство полное окисление или горение.
Алкены сгорают, как и другие углеводороды, до углекислого газа и воды. Запишем уравнение сгорания алкенов в общем виде.
Молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле алкена, поскольку в состав молекулы CO 2 входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть 2n/2, а значит просто n.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа плюс n из воды, итого 3n. Слева атомов кислорода столько же, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть 3n/2 молекул кислорода. Можно записать 1,5n.
Мы рассмотрели восемь химических свойств алкенов.
Тема урока: Алкены. Получение, химические свойства и применение алкенов.
Цели и задачи урока:
- рассмотреть конкретные химические свойства этилена и общие свойства алкенов;
- углубить и конкретизировать понятия о?-связи, о механизмах химических реакций;
- дать первоначальные представления о реакциях полимеризации и строении полимеров;
- разобрать лабораторные и общие промышленные способы получения алкенов;
- продолжить формирование умения работать с учебником.
Оборудование: прибор для получения газов, раствор КМnO 4 , этиловый спирт, концентрированная серная кислота, спички, спиртовка, песок, таблицы «Строение молекулы этилена», «Основные химические свойства алкенов», демонстрационные образцы «Полимеры».
ХОД УРОКА
I. Организационный момент
Мы продолжаем изучение гомологического ряда алкенов. Сегодня нам предстоит рассмотреть способы получения, химические свойства и применение алкенов. Мы должны охарактеризовать химические свойства, обусловленные двойной связью, получить первоначальные представления о реакциях полимеризации, рассмотреть лабораторные и промышленные способы получения алкенов.
II. Активизация знаний учащихся
- Какие углеводороды называются алкенами?
- Каковы особенности их строения?
- В каком гибридном состоянии находятся атомы углерода, образующие двойную связь в молекуле алкена?
Итог: алкены отличаются от алканов наличием в молекулах одной двойной связи, которая обуславливает особенности химических свойств алкенов, способов их получения и применения.
III. Изучение нового материала
1. Способы получения алкенов
Составить уравнения реакций, подтверждающих способы получения алкенов
– крекинг алканов C 8 H 18 ––> C
4 H
8
+ C 4 H 10 ; (термический крекинг при 400-700 o С)
октан
бутен
бутан
– дегидрирование алканов C 4 H 10 ––> C 4 H 8
+ H 2 ; (t, Ni)
бутан
бутен
водород
– дегидрогалогенирование галогеналканов C 4 H 9 Cl
+ KOH ––> C 4 H 8 + KCl
+ H 2 O;
хлорбутан
гидроксид бутен
хлорид
вода
калия
калия
– дегидрогалогенирование дигалогеналканов 
– дегидратация спиртов С 2 Н 5 ОН ––> С 2 Н 4
+ Н 2 О (при нагревании в присутствии
концентрированной серной кислоты)
Запомните!
При реакиях
дегидрирования, дегидратации,
дегидрогалогенирования и дегалогенирования
нужно помнить, что водород преимущественно
отрывается от менее гидрогенизированных атомов
углерода (правило Зайцева, 1875 г.)
2. Химические свойства алкенов
Характер углерод – углеродной связи
определяет тип химических реакций, в которые
вступают органические вещества. Наличие в
молекулах этиленовых углеводородов двойной
углерод – углеродной связи обуславливает
следующие особенности этих соединений:
– наличие двойной связи позволяет отнести
алкены к ненасыщенным соединениям. Превращение
их в насыщенные возможно только в результате
реакций присоединения, что является основной
чертой химического поведения олефинов;
– двойная связь представляет собой значительную
концентрацию электронной плотности, поэтому
реакции присоединения носят электрофильный
характер;
– двойная связь состоит из одной - и одной -связи, которая достаточно легко
поляризуется.
Уравнения реакций, характеризующих химические свойства алкенов
а) Реакции присоединения
Запомните! Реакции замещения свойственны алканам и высшим циклоалканам, имеющим только одинарные связи, реакции присоединения – алкенам, диенам и алкинам, имеющим двойные и тройные связи.

Запомни! Возможны следующие механизмы разрыва -связи:
а) если алкены и реагент – неполярные соединения, то -связь разрывается с образованием свободного радикала:
H 2 C = CH 2 + H: H ––> + +
б) если алкен и реагент – полярные соединения, то разрыв -связи приводит к образование ионов:
в) при соединении по месту разрыва -связи реагентов, содержащих в составе молекулы атомы водорода, водород всегда присоединяется к более гидрированному атому углерода (правило Морковникова, 1869 г.).
– реакция полимеризации nCH 2 = CH 2
––> n – CH 2 – CH 2 –– > (– CH 2 – CH 2
–)n
этен
полиэтилен
б) реакция окисления
Лабораторный опыт. Получить этилен и изучить его свойства (инструкция на столах учащихся)
Инструкция по получению этилена и опытов с ним
1. Поместите в пробирку 2 мл концентрированной
серной кислоты, 1 мл спирта и небольшое
количество песка.
2. Закройте пробирку пробкой с газоотводной
трубкой и нагрейте в пламени спиртовки.
3. Выделяющийся газ пропустите через раствор с
перманганатом калия. Обратите внимание на
изменение цвета раствора.
4. Подожгите газ у конца газоотводной трубки.
Обратите внимание на цвет пламени.
– алкены горят светящимся пламенем. (Почему?)
C 2 H 4 + 3O 2 ––> 2CO 2 + 2H 2 O (при полном окислении продуктами реакции являются углекислый газ и вода)
Качественная реакция: «мягкое окисление (в водном растворе)»
– алкены обесцвечивают раствор перманганата калия (реакция Вагнера)
При более жёстких условиях в кислой среде продуктами реакции могут быть карбоновые кислоты, например (в присутствии кислот):
CH 3 – CH = CH 2 + 4 [O] ––> CH 3 COOH + HCOOH
– каталичесикое окисление
Запомните главное!
1. Непредельные углеводороды активно вступают в
реакции присоединения.
2. Реакционная активность алкенов связана с тем,
что - связь под
действием реагентов легко разрывается.
3. В результате присоединения происходит переход
атомов углерода из sp 2 – в sp 3 -
гибридное состояние. Продукт реакции имеет
предельный характер.
4. При нагревании этилена, пропилена и других
алкенов под давление или в присутствии
катализатора их отдельные молекулы соединяются
в длинные цепочки – полимеры. Полимеры
(полиэтилен, полипропилен) имеют большое
практическое значение.
3. Применение алкенов (сообщение учащегося по следующему плану).
1 – получение горючего с высоким октановым числом;
2 – пластмасс;
3 – взрывчатых веществ;
4 – антифризов;
5 – растворителей;
6 – для ускорения созревания плодов;
7 – получение ацетальдегида;
8 – синтетического каучука.
III. Закрепление изученного материала

Домашнее задание: §§ 15, 16, упр. 1, 2, 3 стр. 90, упр. 4, 5 стр. 95.
Простейшим алкеном является этен C 2 H 4 .По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.


Пространственная структура этилена
По названию первого представителя этого ряда - этилена - такие углеводороды называют этиленовыми.
Номенклатура и изомерия
Номенклатура
Алкены простого строения часто называют, заменяя суффикс -ан в алканах на -илен: этан - этилен, пропан - пропилен и т.д.
По систематической номенклатуре названия этиленовых углеводородов производят заменой суффикса -ан в соответствующих алканах на суффикс -ен (алкан - алкен, этан - этен, пропан - пропен и т.д.). Выбор главной цепи и порядок названия тот же, что и для алканов. Однако в состав цепи должна обязательно входить двойная связь. Нумерацию цепи начинают с того конца, к которому ближе расположена эта связь. Например:


Иногда используют и рациональные названия. В этом случае все алкеновые углеводороды рассматривают как замещенные этилена:

Непредельные (алкеновые) радикалы называют тривиальными названиями или по систематической номенклатуре:
Н 2 С = СН - - винил (этенил)
Н 2 С = CН - СН 2 - -аллил (пропенил-2)
Изомерия
Для алкенов характерны два вида структурной изомерии. Кроме изомерии, связанной со строением углеродного скелета (как у алканов), появляется изомерия, зависящая от положения двойной связи в цепи. Это приводит к увеличению числа изомеров в ряду алкенов.
Первые два члена гомологического ряда алкенов -(этилен и пропилен) - изомеров не имеют и их строение можно выразить так:
H 2 C = CH 2 этилен (этен)
H 2 C = CH - CH 3 пропилен (пропен)
Изомерия положения кратной связи
H 2 C = CH - CH 2 - CH 3 бутен-1
H 3 C - CH = CH - CH 3 бутен-2
Геометрическая изомерия - цис-, транс- изомерия.
Такая изомерия характерна для соединений с двойной связью.
Если простая σ -связь допускает свободное вращение отдельных звеньев углеродной цепи вокруг своей оси, то вокруг двойной связи такого вращения не происходит. Это и является причиной появления геометрических (цис-, транс- ) изомеров.
Геометрическая изомерия - один из видов пространственной изомерии.
Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами,а по разную - транс-изомерами:


Цис- и транс- изомеры отличаются не только пространственным строением, но и многими физическими и химическими свойствами. Транс- изомеры более устойчивы, чем цис- изомеры.
Получение алкенов
В природе алкены встречаются редко. Обычно газообразные алкены (этилен, пропилен, бутилены) выделяют из газов нефтепереработки (при крекинге) или попутных газов, а также из газов коксования угля.
В промышленности алкены получают дегидрированием алканов в присутствии катализатора (Сr 2 О 3).
Дегидрирование алканов
H 3 C - CH 2 - CH 2 - CH 3 → H 2 C = CH - CH 2 - CH 3 + H 2 (бутен-1)
H 3 C - CH 2 - CH 2 - CH 3 → H 3 C - CH = CH - CH 3 + H 2 (бутен-2)
Из лабораторных способов получения можно отметить следующие:
1. Отщепление галогеноводорода от галогеналкилов при действии на них спиртового раствора щелочи:
2. Гидрирование ацетилена в присутствии катализатора (Pd):
H-C ≡ C-H + H 2 → H 2 C = CH 2
3. Дегидратация спиртов (отщепление воды).
В качестве катализатора используют кислоты (серную или фосфорную) или Аl 2 O 3:
В таких реакциях водород отщепляется от наименее гидрогенизированного (с наименьшим числом водородных атомов) углеродною атома (правило А.М.Зайцева):

Физические свойства
Физические свойства некоторых алкенов показаны в таблице ниже. Первые три представителя гомологического ряда алкенов (этилен, пропилен и бутилен) - газы, начиная с C 5 H 10 (амилен, или пентен-1) - жидкости, а с С 18 Н 36 - твердые вещества. С увеличением молекулярной массы повышаются температуры плавления и кипения. Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение. Температуры кипения цис -изомеров выше, чем транс -изомеров, а температуры плавления - наоборот.
Алкены плохо растворимы в воде (однако лучше, чем соответствующие алканы), но хорошо - в органических растворителях. Этилен и пропилен горят коптящим пламенем.
Физические свойства некоторых алкенов
Название |
t пл,°С |
t кип,°С |
||
Этилен (этен) |
||||
Пропилен (пропен) |
||||
Бутилен (бутен-1) |
||||
Цис-бутен-2 |
||||
Транс-бутен-2 |
||||
Изобутилен (2-метилпропен) |
||||
Амилен (пентен-1) |
||||
Гексилен (гексен-1) |
||||
Гептилен (гептен-1) |
||||
Октилен (октен-1) |
||||
Нонилен (нонен-1) |
||||
Децилен (децен-1) |
Алкены малополярны, но легко поляризуются.
Химические свойства
Алкены обладают значительной реакционной способностью. Их химические свойства определяются, главным образом, двойной углерод-углеродной связью.
π-Связь, как наименее прочная и более доступная, при действии реагента разрывается, а освободившиеся валентности углеродных атомов затрачиваются на присоединение атомов, из которых состоит молекула реагента. Это можно представить в виде схемы:

Таким образом, при реакциях присоединения двойная связь разрывается как бы наполовину (с сохранением σ-связи).
Для алкенов, кроме присоединения, характерны еще реакции окисления и полимеризации.
Реакции присоединения
Чаще реакции присоединения идут по гетеролитическому типу, являясь реакциями электрофильного присоединения.
1. Гидрирование (присоединение водорода). Алкены, присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), переходят в предельные углеводороды - алканы:
Н 2 С = СН 2 + H 2 → Н 3 С - СН 3 (этан)
2. Галогенирование (присоединение галогенов). Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных:
Н 2 С = СН 2 + Cl 2 → ClH 2 C - CH 2 Cl (1,2-дихлорэтан)
Легче идет присоединение хлора и брома, труднее - иода. Фтор с алкенами, как и с алканами, взаимодействует со взрывом.



Сравните: у алкенов реакция галогенирования - процесс присоединения, а не замещения (как у алканов).
Реакцию галогенирования обычно проводят в растворителе при обычной температуре.
Присоединение брома и хлора к алкенам происходит по ионному, а не по радикальному механизму. Этот вывод следует из того, что скорость присоединения галогена не зависит от облучения, присутствия кислорода и других реагентов, инициирующих или ингибирующих радикальные процессы. На основании большого числа экспериментальных данных для этой реакции был предложен механизм, включающий несколько последовательных стадий. На первой стадии происходит поляризация молекулы галогена под действием электронов π-связи. Атом галогена, приобретающий некоторый дробный положительный заряд, образует с электронами π-связи нестабильный интермедиат, называемый π-комплексом или комплексом с переносом заряда. Следует отметить, что в π-комплексе галоген не образует направленной связи с каким-нибудь конкретным атомом углерода; в этом комплексе просто реализуется донорно-акцепторное взаимодействие электронной пары π-связи как донора и галогена как акцептора.

Далее π-комплекс превращается в циклический бромониевый ион. В процессе образования этого циклического катиона происходит гетеролитический разрыв связи Br-Br и пустая р -орбиталь sp 2 -гибридизованного атома углерода перекрывается с р -орбиталью "неподеленной пары" электронов атома галогена, образуя циклический ион бромония.

На последней, третьей стадии анион брома как нуклеофильный агент атакует один из атомов углерода бромониевого иона. Нуклеофильная атака бромид-иона приводит к раскрытию трехчленного цикла и образованию вицинального дибромида (vic -рядом). Эту стадию формально можно рассматривать как нуклеофильное замещение S N 2 у атома углерода, где уходящей группой является Br + .

Результат этой реакции нетрудно предвидеть: анион брома атакует карбкатион с образованием дибромэтана.
Быстрое обесцвечивание раствора брома в СCl 4 служит одним из простейших тестов на ненасыщенность, поскольку и алкены, и алкины, и диены быстро реагируют с бромом.
Присоединение брома к алкенам (реакция бромирования) - качественная реакция на предельные углеводороды. При пропускании через бромную воду (раствор брома в воде) непредельных углеводородов желтая окраска исчезает (в случае предельных - сохраняется).
3. Гидрогалогенирование (присоединение галогеноводородов). Алкены легко присоединяют галогенводороды:
H 2 С = СН 2 + НВr → Н 3 С - CH 2 Вr
Присоединение галогенводородов к гомологам этилена идет по правилу В.В.Марковникова (1837 - 1904): при обычных условиях водород галогенводорода присоединяется по месту двойной связи к наиболее гидрогенизированному атому углерода, а галоген - к менее гидрогенизированному:

Правило Марковникова можно объяснить тем, что у несимметричных алкенов (например, в пропилене) электронная плотность распределена неравномерно. Под влиянием метильной группы, связанной непосредственно с двойной связью, происходит смещение электронной плотности в сторону этой связи (на крайний углеродный атом).
Вследствие такого смещения p-связь поляризуется и на углеродных атомах возникают частичные заряды. Легко представить, что положительно заряженный ион водорода (протон) присоединится к атому углерода (электрофильное присоединение), имеющему частичный отрицательный заряд, а анион брома - к углероду с частичным положительным зарядом.
Такое присоединение является следствием взаимного влияния атомов в органической молекуле. Как известно, электроотрицательность атома углерода немного выше, чем водорода.
Поэтому в метильной группе наблюдается некоторая поляризация σ-связей С-Н, связанная со смещением электронной плотности от водородных атомов к углероду. В свою очередь это вызывает повышение электронной плотности в области двойной связи и особенно на ее крайнем, атоме. Таким образом, метильная группа, как и другие алкильные группы, выступает в качестве донора электронов. Однако в присутствии пероксидных соединений или О 2 (когда реакция имеет радикальный характер) эта реакция может идти и против правила Марковникова.
По тем же причинам правило Марковникова соблюдается при присоединении к несимметричным алкенам не только галогеноводородов, но и других электрофильных реагентов (H 2 O, H 2 SО 4 , НОСl, ICl и др.).
4. Гидратация (присоединение воды). В присутствии катализаторов к алкенам присоединяется вода с образованием спиртов. Например:
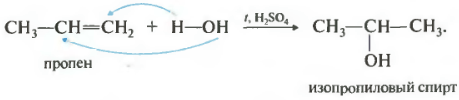
H 3 C - CH = CH 2 + H - OH → H 3 C - CHOH - CH 3 (изопропиловый спирт)
Реакции окисления
Алкены окисляются легче, чем алканы. Продукты, образованные при окислении алкенов, и их строение зависят от строения алкенов и от условий проведения этой реакции.
1. Горение
Н 2 С = СН 2 + 3O 2 → 2СO 2 + 2Н 2 O
2. Неполное каталитическое окисление

3. Окисление при обычной температуре. При действии на этилен водного раствора КМnO 4 (при нормальных условиях, в нейтральной или щелочной среде - реакция Вагнера) происходит образование двухатомного спирта - этиленгликоля:
3H 2 C = CH 2 + 2KMnO 4 + 4H 2 O → 3HOCH 2 - CH 2 OH (этиленгликоль)+ 2MnO 2 + KOH
Эта реакция является качественной: фиолетовая окраска раствора перманганата калия изменяется при добавлении к нему непредельного соединения.
В более жестких условиях (окисление КМnO 4 в присутствии серной кислоты или хромовой смесью) в алкене происходит разрыв двойной связи с образованием кислородсодержащих продуктов:
H 3 C - CH = CH - CH 3 + 2O 2 → 2H 3 C - COOH (уксусная кислота)
Реакция изомеризации
При нагревании или в присутствии катализаторов алкены способны изомеризоваться - происходит перемещение двойной связи или установление изостроения.
Реакции полимеризации
За счет разрыва π-связей молекулы алкена могут соединяться друг с другом, образуя длинные цепные молекулы.

Нахождение в природе и физиологическая роль алкенов
В природе ациклические алкены практически не встречаются. Простейший представитель этого класса органических соединений - этилен C 2 H 4 - является гормоном для растений и в незначительном количестве в них синтезируется.
Один из немногих природных алкенов - мускалур (цис- трикозен-9) является половым аттрактантом самки домашней мухи (Musca domestica) .
Низшие алкены в высоких концентрациях обладают наркотическим эффектом. Высшие члены ряда также вызывают судороги и раздражение слизистых оболочек дыхательных путей
Отдельные представители
Этилен (этен) - органическое химическое соединение,описываемое формулой С 2 H 4 . Является простейшим алкеном. Содержит двойную связь и поэтому относится к ненасыщенным или непредельным углеводородам. Играет чрезвычайно важную роль в промышленности, а также является фитогормоном (низкомолекулярные органические вещества, вырабатываемые растениями и имеющие регуляторные функции).
Этилен - вызывает наркоз, обладает раздражающим и мутагенным действием.
Этилен - самое производимое органическое соединение в мире; общее мировое производство этилена в 2008 году составило 113 миллионов тонн и продолжает расти на 2-3% в год.
Этилен является ведущим продуктом основного органического синтеза и применяется для получения полиэтилена (1-е место, до 60 % всего объёма).
Полиэтилен - термопластичный полимер этилена. Самый распространенный в мире пластик.
Представляет собой воскообразную массу белого цвета (тонкие листы прозрачный бесцветны). Химически- и морозостоек, изолятор, не чувствителен к удару (амортизатор), при нагревании размягчается (80-120°С), при охлаждении застывает, адгезия (сцепление поверхностей разнородных твёрдых и/или жидких тел) - чрезвычайно низкая. Иногда в народном сознании отождествляется с целлофаном - похожим материалом растительного происхождения.
Пропилен - вызывает наркоз (сильнее, чем этилен), оказывает общетоксическое и мутагенное действие.
Устойчив к действию воды, не реагирует с щелочами любой концентрации, с растворами нейтральных, кислых и основных солей, органическими и неорганическими кислотами, даже концентрированной серной кислоты, но разлагается при действии 50%-ой азотной кислоты при комнатной температуре и под воздействием жидкого и газообразного хлора и фтора. Со временем, происходит термостарение.
Полиэтиленовая плёнка (особенно упаковочных, например, пузырчатая упаковка или скотч).


Тара (бутылки, банки, ящики, канистры, садовые лейки, горшки для рассады.
Полимерные трубы для канализации, дренажа, водо-, газоснабжения.

Электроизоляционный материал.
Полиэтиленовый порошок используется как термоклей.

Бутен-2 - вызывает наркоз, обладает раздражающим действием.



